
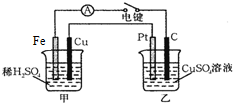
 原电池和电解池都能实现能量的置换.回答下列问题:
原电池和电解池都能实现能量的置换.回答下列问题:分析 (1)能自发的发生氧化还原反应,能构成原电池,原电池中化学能转化为电能;
(2)能自发的发生氧化还原反应能设计成原电池;
(3)FeCl3溶液与Cu反应生成氯化亚铁和氯化铜;
(4)甲中Fe为负极,Cu为正极,Pt电极为阳极,阳极上氢氧根离子失电子生成氧气;甲中Cu电极上氢离子得电子生成氢气,乙中C上铜离子得电子生成Cu,根据电子守恒计算.
解答 解:(1)能自发的发生氧化还原反应,能构成原电池,原电池中化学能转化为电能,甲中Fe、Cu和稀硫酸构成原电池,即甲池可将化学能转化为电能;
故答案为:甲;
(2)能自发的发生氧化还原反应能设计成原电池,
①2FeCl3+Fe═3FeCl2属于能自发的发生氧化还原反应,能设计成原电池,故正确;
②AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl,属于复分解反应,不是氧化还原反应,不能设计成原电池,故错误;
③NaOH+HCl═NaC1+H2O,属于复分解反应,不是氧化还原反应,不能设计成原电池,故错误;
故答案为:①;
(3)FeCl3溶液与Cu反应生成氯化亚铁和氯化铜,其反应的离子方程式为:2Fe3++Cu=Cu2++2Fe2+;
故答案为:2Fe3++Cu=Cu2++2Fe2+;
(4)甲中Fe为负极,Cu为正极,Pt电极为阳极,阳极上氢氧根离子失电子生成氧气,其电极方程式为:2H2O-4e-=O2↑+4H+;
甲中Cu电极上氢离子得电子生成氢气,电极方程式为:2H++2e-=H2↑,产生0.1mol气体时,转移电子为0.2mol,乙中C上铜离子得电子生成Cu,其电极反应为Cu2++2e-=Cu,转移0.2mol电子时生成0.1molCu,所以Cu的质量为64g/mol×0.1mol=6.4g;
故答案为:2H2O-4e-=O2↑+4H+;6.4.
点评 本题考查了原电池原理和电解原理的应用,明确正负极、阴阳极上放电的物质或离子是解本题关键,注意电子守恒在计算中的应用,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
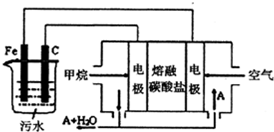 电浮选凝聚法是工业上采用的一种污水处理方法,通过电解污水最终生成的Fe(OH)3吸附污物而沉积下来,达到净水的目的.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用,某科研小组利用上述原理,设计出如图所示的装置.
电浮选凝聚法是工业上采用的一种污水处理方法,通过电解污水最终生成的Fe(OH)3吸附污物而沉积下来,达到净水的目的.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用,某科研小组利用上述原理,设计出如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向Fe(NO3)2样品溶于稀H2SO4 | 溶液不变红 | 稀硫酸不能氧化Fe2+ |
| C | 将SO2通入Ba(N03)2溶液中 | 无明显现象 | SO2与Ba(NO3)2不反应 |
| D | 葡萄糖溶液与新制Cu(OH)2混合加热 | 生成砖红色沉淀 | 葡萄糖分子中含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若容器内压强不再变化,则说明该反应己达平衡 | |
| B. | 反应前H2S物质的量为2.5mol | |
| C. | CO和H2S达平衡后的转化率相同 | |
| D. | 若平衡后再加入CO,则正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol | B. | 2 mol | C. | 7 mol | D. | 8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高体系温度,平衡常数K减小 | |
| B. | 增大体系压强,平衡常数K不发生变化 | |
| C. | 平衡常数表达式为K=$\frac{[CO][{H}_{2}]}{[C][{H}_{2}O]}$ | |
| D. | 增加C(s)的量,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池是一种将化学能转化为电能的装置 | |
| B. | 铁船舶的外壳上镶嵌锌块,可避免船体遭受腐蚀 | |
| C. | 钢铁腐蚀时负极的电极反应式:Fe-3e-═Fe+ | |
| D. | 工业上电解饱和食盐水时阴极的电极反应式:2H++2e-═H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com