
| A. | 由“Cl2+H2O═HCl+HClO”可推出“Br2+H2O═HBr+HBrO”也能发生 | |
| B. | Na与水反应生成NaOH和H2,故所有碱金属与水反应都能生成对应的碱和H2 | |
| C. | HCl的水溶液是强酸,推出HF的水溶液也是强酸 | |
| D. | 由“2Fe+3Cl2═2FeCl3”反应可推出“2Fe+3I2═2FeI3”反应也能发生 |
分析 A.Cl、Br元素位于同一主族,性质具有相似性,二者单质都能和水发生歧化反应生成氢卤酸和次卤酸;
B.碱金属族元素单质都能和水反应生成碱和氢气,所以称为碱金属族元素;
C.HF在水溶液里部分电离,为弱电解质;
D.氯气具有强氧化性,能将变价金属氧化为最高价,碘氧化性较氯气弱,将变价金属氧化为较低价态.
解答 解:A.卤族元素单质性质具有相似性,能和水反应生成HX、HXO,但F元素除外,氟气和水反应生成HF和氧气,所以由“Cl2+H2O═HCl+HClO”可推出“Br2+H2O═HBr+HBrO”也能发生,故A正确;
B.碱金属族元素单质都能和水反应生成碱和氢气,所以称为碱金属族元素,其单质与水反应通式为2R+2H2O=2ROH+H2↑,所以Na与水反应生成NaOH和H2,所有碱金属与水反应都能生成对应的碱和H2,故B正确;
C.HF中F原子吸引电子能力很强,导致HF在水溶液里电离程度很小,所以HF部分电离,为弱电解质,其水溶液为弱酸,故C错误;
D.氯气具有强氧化性,能将变价金属氧化为最高价,碘氧化性较氯气弱,将变价金属氧化为较低价态,所以氯气和铁反应方程式为“2Fe+3Cl2═2FeCl3”、碘和铁反应方程式为“Fe+I2═FeI2”,故D错误;
故选AB.
点评 本题考查化学反应规律,为高考高频点,明确同一主族元素性质相同点及差异性是解本题关键,注意氟气和水反应生成氧气,易错选项是AD.


科目:高中化学 来源: 题型:填空题
 表示的分子式C6H14;名称2-甲基戊烷.
表示的分子式C6H14;名称2-甲基戊烷. 中含有的官能团的名称为酚羟基、酯基.
中含有的官能团的名称为酚羟基、酯基.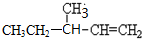 3-甲基-1-戊烯.
3-甲基-1-戊烯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PCl5 | B. | CCl4 | C. | NF3 | D. | N3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
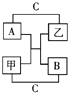 A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间 存在如下关系:若A为单质有色气体,请判断:(填化学式)A是Cl2,B是S,C是H2,甲是H2S,乙是HCl.
A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间 存在如下关系:若A为单质有色气体,请判断:(填化学式)A是Cl2,B是S,C是H2,甲是H2S,乙是HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl中存在离子键,属于离子化合物 | |
| B. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| C. | 阴阳离子通过静电引力而形成的化学键称为离子键 | |
| D. | 非金属元素组成的化合物中只含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
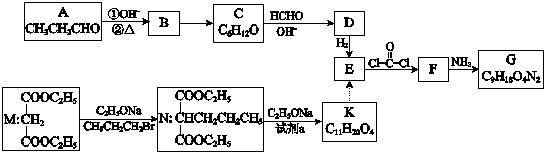
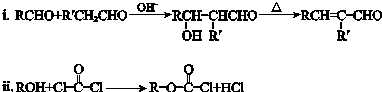
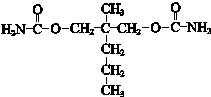 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
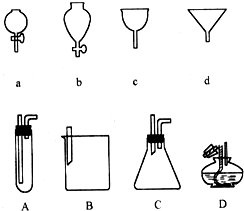 如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.
如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体密度一定减小 | B. | 平衡一定向逆反应方向移动 | ||
| C. | 化学计量数:m+n<3 | D. | 物质C的体积分数减小了 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com