
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
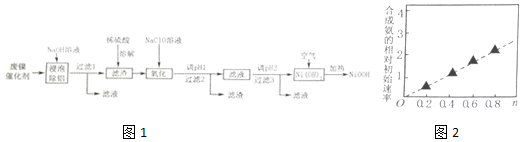
分析 镍催化剂中含Ni 64.0%,Al 24.3%、Fe 1.4%,其余为SiO2和有机物,废催化剂中加入碱液,Al、SiO2分别和碱液发生反应2Al+2OH-+2H2O═2AlO2-+3H2↑、SiO2+2OH-=SiO32-+H2O,然后过滤,滤液A中含有NaAlO2、Na2SiO3,
其余为滤渣a,滤渣a中加入硫酸,金属Fe变为Fe2+,Ni变为Ni2+,过滤后,其余为滤渣b,滤液B中含有FeSO4、NiSO4,向滤液B中加入双氧水的目的是把Fe2+氧化为Fe3+,以便与调节pH使其生成沉淀除去,即溶液C中含有Fe3+、Ni2+等,调节pH=6,得到沉淀为Fe(OH)3,过滤得到滤渣c为Fe(OH)3,得到滤液D为含有Ni2+的溶液,然后继续调节pH值,最后蒸发结晶即可得到目标产物,据此分析解答;
(1)“浸泡除铝”时,利用铝是两性金属,能溶解于NaOH溶液,生成偏铝酸钠和氢气,结合电子守恒和原子守恒,书写化学方程式;
(2)“溶解”时用稀硫酸溶解Ni、Cr及FeS生成盐和氢气或硫化氢,根据反应原理解答;根据图示判断,合成氨始速率越大与Ni2+及Co2+的关系;
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被NaClO氧化为Fe3+,根据电子守恒、电荷守恒及原子守恒书写此反应的离子方程式;
(4)根据图表,结合Fe3+和Cr2+全部沉淀时溶液的pH,镍离子开始沉淀时溶液pH判断调整范围;
(5)在加热条件下Ni(OH)2与空气中氧气反应得到碱式氧化镍(NiOOH),根据电子守恒和原子守恒书写此反应的化学方程式;
(6)可充电池充电时是原电池,放电时是电解池,充电时的阳极发生氧化反应,放电时阴极发生氧化反应,根据总反应式并结合氧化还原反应理论进行判断.
解答 解:(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(2)“溶解”时为Ni、Cr、FeS与稀硫酸反应,Ni+H2SO4═NiSO4+H2↑、Cr+H2SO4═CrSO4+H2↑、FeS+H2SO4═NiSO4+H2S↑;由图可知,随n值越大,合成氨的相对初始速率越大,而n增大,Co2+的比例增大,故Co2+的催化活性更高,
故答案为:H2、H2S;Co2+;
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被NaClO氧化为Fe3+,其离子方程式为:ClO-+2Fe2++2H+=2Fe3++Cl-+2H2O;
故答案为:ClO-+2Fe2++2H+=2Fe3++Cl-+2H2O;
(4)加入Ni(OH)2调节溶液PH使Fe3+和Cr2+全部沉淀,镍离子不沉淀,故pH范围为5.6~6.2;
故答案为:5.6~6.2;Cr(OH)2和Fe(OH)3;
(5)在加热条件下Ni(OH)2与空气反应得到碱式氧化镍(NiOOH),化学方程式为:4Ni(OH)2+O2$\frac{\underline{\;加热\;}}{\;}$4NiOOH+2H2O;
故答案为:4Ni(OH)2+O2$\frac{\underline{\;加热\;}}{\;}$4NiOOH+2H2O;
(6)阳极电极反应方程式为:Ni(OH)2+OH--e-=NiOOH+H2O;放电为原电池,负极失去电子,发生氧化反应,电极反应方程式为:MHx+xOH--xe-=M++xH2O,
故答案为:Ni(OH)2+OH--e-=NiOOH+H2O;MHx+xOH--xe-=M++xH2O.
点评 本题以化学工艺流程为载体考查物质分离和提纯,涉及基本操作、物质性质、物质分离和提纯、原电池和电解池原理等知识点,明确流程图中各个过程发生的反应、基本操作方法及物质性质是解本题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| B. | 室温下,测得氯化铵溶液pH<7:NH4++H2O=NH3•H2O+H+ | |
| C. | 石灰水中加入过量碳酸氢钠溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 用小苏打片治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验1 | 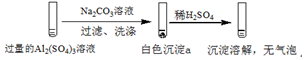 |
| 实验2 | 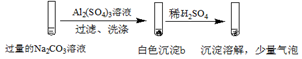 |
| A. | 实验1中,白色沉淀a是Al(OH)3 | |
| B. | 实验2中,白色沉淀b含有CO32- | |
| C. | 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关 | |
| D. | 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用过量的乙酸 | B. | 采用边反应边蒸馏的方法 | ||
| C. | 反应采用水浴加热 | D. | 用氢氧化钠溶液提纯乙酸丁酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | Cu(OH)2固体与稀硫酸反应:OH-+H+═H2O | |
| D. | 铝片与NaOH溶液反应:Al+OH-+H2O═AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲基(CH3-)所含的电子数分别为10NA | |
| B. | 标准状况下,22.4 L四氯化碳中含有C-Cl键的数目为4NA | |
| C. | 常温常压下,1 mol分子式为C2H6O的有机物中,含有C-O键的数目为NA | |
| D. | 46g 由NO2和N2O4组成的混合气体中,含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )| A. | Z与M的最高价氧化物对应水化物均为强酸 | |
| B. | X、Y、Z三种元素组成的化合物可能是酸、碱或盐 | |
| C. | 简单离子半径:M>Y>Q | |
| D. | 电解RM2水溶液可得到R单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| A | B | C | D | |
| 装置甲中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 白色沉淀 | ----- | ------ |
| 装置乙中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 有气泡 | 有气泡 | 品红褪色 |

| 步骤I | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤II | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭还原氧化铜的硬质玻璃管(盐酸) | |
| B. | 碘升华实验的试管(酒精) | |
| C. | 长期存放氯化铁溶液的试剂瓶(稀硫酸) | |
| D. | 沾有油污的烧杯(纯碱溶液) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com