
【题目】人体血液存在H2CO3/HCO3—、HPO42-/H2PO4—等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示![]() 或
或![]() ]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是
]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是

A. 曲线Ⅱ表示lg![]() 与pH的变化关系
与pH的变化关系
B. a~b的过程中,水的电离程度逐渐增大
C. 当c(H2CO3) ═c (HCO3—)时,c(HPO42—)=c(H2PO4—)
D. 当pH增大时,![]() 逐渐增大
逐渐增大
【答案】D
【解析】
由电离平衡H2CO3 ![]() HCO3-+H+、H2PO4-
HCO3-+H+、H2PO4- ![]() HPO42-+H+可知,随pH增大,溶液中c(OH-)增大,使电离平衡向右移动,H2CO3 /HCO3-减小,HPO42-/H2PO4-增大,所以曲线I表示lg[H2CO3 /HCO3-)]与pH的变化关系,曲线II表示lg[c(HPO42-)/c(H2PO4-)]与pH的变化关系,以此分析解答。
HPO42-+H+可知,随pH增大,溶液中c(OH-)增大,使电离平衡向右移动,H2CO3 /HCO3-减小,HPO42-/H2PO4-增大,所以曲线I表示lg[H2CO3 /HCO3-)]与pH的变化关系,曲线II表示lg[c(HPO42-)/c(H2PO4-)]与pH的变化关系,以此分析解答。
A. 根据以上分析,曲线I表示lg[H2CO3 /HCO3-)]与pH的变化关系,故A错误;
B. 曲线I表示lg[H2CO3 /HCO3-)]与pH的变化关系,a→b的过程中,c(HCO3-)逐渐增大,对水的电离促进作用增大,所以水的电离程度逐渐增大,故B错误;
C. 根据H2CO3 ![]() HCO3-+H+,Kal=
HCO3-+H+,Kal=![]() ;H2PO4-
;H2PO4- ![]() HPO42-+H+,Ka2=
HPO42-+H+,Ka2=![]() ;由题给信息可知,Ka1
;由题给信息可知,Ka1![]() Ka2,则当c(H2CO3) =c(HCO3— )时c(HPO42-)
Ka2,则当c(H2CO3) =c(HCO3— )时c(HPO42-)![]() c(H2PO4-),故C错误;
c(H2PO4-),故C错误;
D. 根据Kal=![]() ;Ka2=
;Ka2=![]() ,可得c(HCO3- )
,可得c(HCO3- )![]() c(H2PO4-)/c(HPO42-)=
c(H2PO4-)/c(HPO42-)=![]() c(H2CO3),
c(H2CO3),
当pH增大时,c(H2CO3)逐渐减小,所以c(HCO3- )![]() c(H2PO4-)/c(HPO42-)逐渐减小,故D正确。
c(H2PO4-)/c(HPO42-)逐渐减小,故D正确。
故答案选D。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D、E之间发生如下的转化:
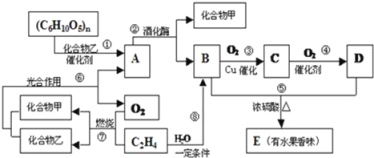
(1)写出D分子中官能团的名称:_____,C物质的结构简式:____.
(2)向A的水溶液中加入新制的Cu(OH)2并加热时产生的实验现象是__________.
(3)请写出下列转化的化学反应方程式:
①(C6H10O5)n→A:_____; ②乙烯生成聚乙烯:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COONa溶液和NaCN溶液,所得滴定曲线如右图(忽略体积变化)。下列说法正确的是

A. 溶液中阳离子的物质的量浓度之和:点②等于点③
B. 点①所示溶液中:c(CN—)+ c(HCN)=2c(Cl—)
C. 点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)> c(CH3COOH)
D. 点④所示溶液中:c(Na+)+ c(CH3COOH)+ c(H+)>0.10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中投入1molC和1molBaSO4,一定温度下发生反应:3C(s)+BaSO4(s)![]() BaS(s)+2CO(g)+CO2(g)(注明:s代表固体,g代表气体)。下列情况下表明该反应达到最大限度(平衡状态)的是( )
BaS(s)+2CO(g)+CO2(g)(注明:s代表固体,g代表气体)。下列情况下表明该反应达到最大限度(平衡状态)的是( )
A.混合气体平均摩尔质量不再变化
B.CO的体积分数不再变化
C.硫酸钡浓度不再变化
D.混合气体密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定Mg2+含量:将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。
(1)30.00mL 5.00 mol·L1的稀硫酸至少能溶解原料的质量为___________。
(2)加氨水调节pH促进Fe3+水解,Fe3+水解离子方程式为___________。
(3)已知:Ksp[Fe(OH)3]=1.0×1039,Ksp[Mg(OH)2]=1.0×1012。室温下,若溶液中c(Mg2+)=0.01mol·L1,欲使溶液中的c(Fe3+)≤1×106mol·L1,需调节溶液pH范围为___________。
(4)常采用下列方法测定结晶硫酸镁中Mg2+的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2)形成配合物
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来: Zn2+ +MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.50g加入过量的EDTA,配成100mL pH9~10之间溶液A
步骤2:准确移取25.00mL溶液A于锥形瓶中,用0.10mol·L1Zn2+标准溶液滴定,滴定到终点,消耗Zn2+标准溶液的体积为20.00mL
步骤3:准确移取25.00mL溶液A于另一只锥形瓶中,调节pH在5~6;用0.10mol·L1Zn2+标准溶液滴定,滴定至终点,消耗Zn2+标准溶液的体积为30.00mL。
计算该结晶硫酸镁中Mg2+的质量分数(请给出计算过程)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A. 加入10mL 0.08mol·L-1的NaOH溶液 B. 加入100mL 的水进行稀释
C. 加水稀释成1L D. 加入10mL 0.01mol·L-1的盐酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚丙烯是日常生活中用途非常广泛的一种塑料,下列说法不正确的是
A. 单体是:CH3-CH=CH2
B. 链节是:-CH3-CH-CH2-
C. 平均相对分子质量=42×n(n为聚合度)
D. 是一种难降解的塑料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知过氧化氢在强碱性溶液中主要以HO2-存在。我国研究的Al-H2O2燃料电池可用于深海资源的勘查、军事侦察等国防科技领域,装置示意图如下。下列说法错误的是
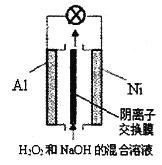
A. 电池工作时,溶液中OH-通过阴离子交换膜向Al极迁移
B. Ni极的电极反应式是HO2-+2e-+H2O=3OH-
C. 电池工作结束后,电解质溶液的pH降低
D. Al电极质量减轻13.5g,电路中通过9.03×1023个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾中含有多种污染物,其中有氮氧化物(NOx)、CO、SO2等,给人类健康带来了严重影响,化学在解决雾霾污染中发挥了重要作用。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原消除污染。请写出CH4与NO2反应的化学方程式_____________。
(2)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-746.8kJ·mol-1
N2(g)+2CO2(g) △H=-746.8kJ·mol-1
4CO(g)+2NO2(g)![]() 3CO2(g)+N2(g) △H=-1200kJ·mol-1
3CO2(g)+N2(g) △H=-1200kJ·mol-1
则反应的CO(g)+NO2(g)![]() CO2(g)+NO(g) △H=_____kJ·mol-1
CO2(g)+NO(g) △H=_____kJ·mol-1
(3)氮硫的氧化物间存在如下转化SO2(g)+NO2(g)![]() SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:
SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:

①该反应正反应的活化能___(填“>”或“<”)逆反应的活化能。
②反应速率v=V正-V逆=k正xSO2·xNO2-k逆xSO3·xNO,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,T℃时,k正_____k逆(填“>”、“<”或“=”)。
③T℃时,在体积为2L的容器中加入1molSO2(g)、1molNO2(g),5min时测得xSO3=0.2,此时平衡向___(填“正”或“逆”)反应方向移动,![]() =___(保留2位小数)。
=___(保留2位小数)。
(4)已知:2NO(g)=N2(g)+O2(g) ΔH=-180.6kJ/mol,在某表面催化剂的作用下,NO可以分解生成N2、O2,其反应机理可简化为:
第一步:2NO →N2O2 快
第二步:N2O2 →N2+O2 慢
下列表述正确的是____(填标号)。
A.所有化合反应都是放热反应
B.N2O2是该反应的的中间产物
C.加入合适的催化剂可以减小反应热ΔH,加快反应速率
D.第一步的活化能比第二步低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com