
| 物质 | 物质的量/mol | 体积(标况)/L | 分子数 | 质量 |
| H2 | 0.5 | |||
| CO2 | 44.8 | |||
| N2 | 6.02×1022 | |||
| O2 | 32 |
分析 结合V=nVm、n=$\frac{m}{M}$、N=nNA及分子构成计算.
解答 解:氢气的物质的量为0.5mol,标况下体积为0.5mol×22.4L/mol=11.2L,分子数为0.5mol×6.02×1023=3.01×1023,其质量为0.5mol×2g/mol=1g;
二氧化碳的体积为44.8L,其物质的量为$\frac{44.8L}{22.4L/mol}$=2mol,分子数为2mol×6.02×1023=12.04×1023,其质量为2mol×44g/mol=88g;
氮气的分子数为6.02×1022,其物质的量为$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$=0.1mol,体积为0.1mol×22.4L/mol=2.24L,质量为0.1mol×28g/mol=2.8g;
氧气的质量为32g,其物质的量为$\frac{32g}{32g/mol}$=1mol,体积为1mol×22.4L/mol=22.4L,分子数为1mol×6.02×1023=6.02×1023,
故答案为:
| 物质 | 物质的量/mol | 体积(标况)/L | 分子数 | 质量(g) |
| H2 | 0.5 | 11.2 | 3.01×1023 | 1 |
| CO2 | 2 | 44.8 | 12.04×1023 | 88 |
| N2 | 0.1 | 2.24 | 6.02×1022 | 2.8 |
| O2 | 1 | 22.4 | 6.02×1023 | 32 |
点评 本题考查物质的量的计算,为高频考点,把握物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 集气瓶内液面上升 | B. | 集气瓶内气体颜色变浅 | ||
| C. | 水槽里溶液仍保持澄清 | D. | 集气瓶壁附有油状液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量(g/mo1)与6.02×1023个磷酸分子的质量(g)在数值上相等 | |
| B. | 6.02×1023个N2和6.02×1023个O2的质量比等于7:8 | |
| C. | 3.2gO2所含的原子数目约为0.2×6.02×1023个 | |
| D. | 常温、常压下,0.5×6.02×1023个二氧化碳分子的质量是44g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
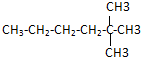 用“键线式”可表示为
用“键线式”可表示为 ,其中每个端点和转折点都表示一个碳原子,氢原子已省略.某有机物分子用键线式表示为
,其中每个端点和转折点都表示一个碳原子,氢原子已省略.某有机物分子用键线式表示为 ,该有机物的分子式为:C10H20,其一氯代物有4种.
,该有机物的分子式为:C10H20,其一氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,H2O2的结构式为H-O-O-H,N-H键的键能为a kJ•mol-1,N-N键的键能为b kJ•mol-1,H-O键的键能为c kJ•mol-1,O-O键的键能为d kJ•mol-1,
,H2O2的结构式为H-O-O-H,N-H键的键能为a kJ•mol-1,N-N键的键能为b kJ•mol-1,H-O键的键能为c kJ•mol-1,O-O键的键能为d kJ•mol-1, 键的键能为e kJ•mol-1,则1mol N2H4与足量H2O2反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=(4a+b-4c+d-e)kJ•mol-1.
键的键能为e kJ•mol-1,则1mol N2H4与足量H2O2反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=(4a+b-4c+d-e)kJ•mol-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com