
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.等体积的CO2和CO,分子数目均为NA
B.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12NA
C.标准状况下,22.4L的H2和22.4L的F2混合后,气体分子数为2NA
D.H2O(g)通过足量Na2O2(s)充分反应,固体增重bg时,反应中转移的电子数为bNA/2
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】钼和钒在炼钢、有机化工、高科技等领域有广泛应用。一种从炼油工业的废催化剂(主要成分为V2O5、MoO3、Al2O3、硫化物和碳氢化合物)中回收钼、钒的工艺流程如图:
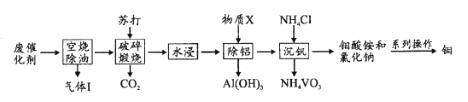
(1)“气体”除CO2、H2O外,还含有的主要成分是____。
(2)“破碎”的目的是____;缎烧中V2O5转化的化学方程式是____。
(3)加人物质X的目的是调节溶液pH除铝,X的化学式是____。
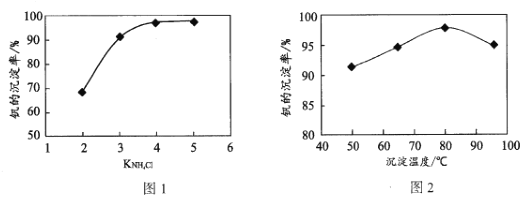
(4)“沉钒”过程中控制pH为8.35,其他条件一定时,钒的沉淀率与加铵系数KNH4Cl、温度的关系分别如图1、图2,则应选择的加铵系数是____;温度超过80°C时,钒的沉淀率下降的原因是____。
(5)钼酸铵[(NH4)2MoO4]在高温下通入H2可制得单质钼,该过程的化学方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。实验室制取氯气除了用浓盐酸和二氧化锰外还可以利用下列反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需要加热。请你根据所学知识回答下列问题
(1)该反应中氧化产物与还原产物的物质的量之比为_____________________。
(2)把氯气通入紫色石蕊溶液中,可以观察到的现象是________________________________。
(3)实验室配制好2.0mol/L NaOH溶液,需要这种溶液____________mL才能与4.48L氯气(标准状况)恰号完全反应。
(4)已知Br2的水溶液因浓度不同而呈现橙色或红棕色,NaBr溶液中缓缓通入Cl2时,可以看到无色溶液逐渐变为红棕色,请写出对应的离子方程式_________________________________。
(5)现需490mL 2.0mol/L NaOH溶液:
ⅰ所需称量的氢氧化钠固体的质量是__________________。
ⅱ上述实验需要的仪器有天平(含砝码)、药匙、烧杯、量筒、玻璃棒、胶头滴管、______________。
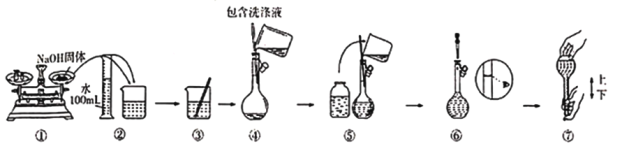
ⅲ某同学部分配制过程如图所示,你认为有错误的操作是_____________________;若按操作所示称量时,指针向左偏,则所配溶液浓度将____________________(填“偏高”“偏低”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图装置进行实验探究,请回答下列问题:

(1)电能转化为化学能的装置为_______池(填“A”或“B”)。
(2)A装置锌为_______极,实验过程中氢离子浓度较大的是区域______(填“Zn电极”或“Cu电极”)。
(3)B装置石墨2为_______极,电极反应式为_______;当石墨1放出2240mL气体(标准状况下)时,电路中转移电子的数目为_________,若A装置也转移相同数量的电子,锌的质量减少了_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.向硫酸铜溶液中加入铁片:3Cu2++2Fe=2Fe3++3Cu
B.石灰石与醋酸反应:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
C.碳酸氢铵与足量热的NaOH溶液反应:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D.向Ba(OH)2溶液中加入少量NaHSO3溶液:2HSO3-+Ba2++2OH-= BaSO3↓+SO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是生产和生活中用量较多的金属。
(1)下列有关铜元素的说法中,不正确的是__________(填字母)
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.铜与O2反应生成黑色的CuO
D.CuSO4·5H2O是一种混合物,加热后变为白色固体
(2)某化学小组为测定某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
①请写出方案Ⅰ中铜与稀硝酸反应的离子方程式:___________,该方案中稀硝酸表现出来的性质是___________(填字母)。
A.挥发性 B.酸性 C.氧化性 D.还原性
②方案Ⅱ比方案Ⅰ更易于实施,理由是________________。请写出方案Ⅱ中发生反应的化学方程式:____________,该反应产生气体在标准状况下的体积为________(铜铝混合物质量是m1g,反应后剩余固体的质量m2g,用含m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子结构如图所示。现有试剂:①Na ②H2/Ni ③Ag(NH3)2OH ④新制Cu(OH)2 ⑤NaOH ⑥酸性KMnO4溶液。能与该化合物中两个或两个以上官能团都发生反应的试剂有( )

A.①②⑤⑥ B.①②④⑥ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为不同化学元素组成的化合物示意图,下列说法正确的是( )
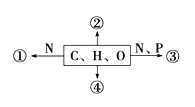
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若②广泛分布在动物细胞内,则其一定是糖原
C. 若③为生物大分子,则其彻底水解产物最多为4种
D. 若④为重要储能物质,则动物和植物细胞都含有这种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com