
【题目】关于如图中各装置的叙述正确的是( )
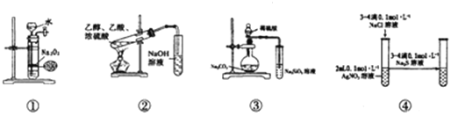
A.装置①可制备少量氧气
B.装置②可用于实验室制取和收集乙酸乙酯
C.装置③的实验可推断硫、碳、硅三种元素的非金属强弱
D.装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH![]() C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
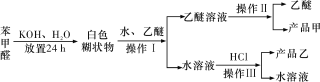
根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是( )
a(干燥气体) |
| |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③B. ①②⑤C. ②④⑤D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式或电离方程式中,不能正确表达反应颜色变化的是
A.将氨气通入滴有酚酞试液的水中,溶液变红:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-
NH4++OH-
B.少量FeCl3溶液滴入沸水中变为红褐色液体:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
C.向CuCl2溶液中加入足量的铁粉,溶液由蓝色变为浅绿色:Fe+CuCl2=Cu+FeCl2
D.呼吸面具使用后,Na2O2由淡黄色逐渐变为白色:2Na2O2=2Na2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、![]() 、NO、
、NO、![]() 是污染空气和水的有害气体,如何合理利用这些有害气体是当今科学研究的方向之一.下面是一些研究方案.
是污染空气和水的有害气体,如何合理利用这些有害气体是当今科学研究的方向之一.下面是一些研究方案.
方案一:转化成无害气体.涉及的反应如下.
反应Ⅰ:![]()
反应Ⅱ:![]()
(1)反应![]() 的
的![]() ________
________![]() .
.
(2)一定条件下,将![]() 与CO以物质的量之比为
与CO以物质的量之比为![]() 置于恒容密闭容器中发生反应Ⅱ,下列能说明反应一定达到平衡状态的是________.
置于恒容密闭容器中发生反应Ⅱ,下列能说明反应一定达到平衡状态的是________.
![]() 每消耗
每消耗![]() 的同时生成
的同时生成![]()
![]() 容器中混合气体密度保持不变
容器中混合气体密度保持不变
![]() 与CO的物质的量之比保持不变
与CO的物质的量之比保持不变
![]() 混合气体颜色保持不变
混合气体颜色保持不变
![]() 混合气体的平均相对分子质量保持不变
混合气体的平均相对分子质量保持不变
(3)向容积为2L的恒容密闭容器中分别充入![]() 和
和![]() ,发生反应
,发生反应
Ⅱ![]() 在不同温度下测定反应相同时间时
在不同温度下测定反应相同时间时![]() 的转化率
的转化率![]() ,结果如图所示.
,结果如图所示.
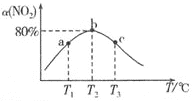
![]() 、c两点反应速率大小关系为
、c两点反应速率大小关系为![]() ________
________![]() 填或“
填或“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 温度为
温度为![]() 时,反应从开始经过
时,反应从开始经过![]() 达到b点,用
达到b点,用![]() 表示这段时间内的平均反应速率为________,此温度下该反应的平衡常数为________
表示这段时间内的平均反应速率为________,此温度下该反应的平衡常数为________![]() 若在此温度下,保持容器的容积不变,b点时再向容器中充入
若在此温度下,保持容器的容积不变,b点时再向容器中充入![]() 和
和![]() ,
,![]() 的平衡转化率将________
的平衡转化率将________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() .
.
![]() 的转化率随温度升高先增大后减小的原因是________.
的转化率随温度升高先增大后减小的原因是________.
方案二:用次氯酸钠处理废水中的氨,使其转化为氮气除去.涉及的反应为![]() .
.
(4)上述反应中HClO来自次氯酸钠溶液,原理是________![]() 用离子方程式表示
用离子方程式表示![]() .
.
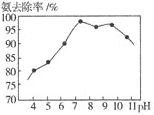
(5)实验测得废水pH与氨去除率的关系如图所示.pH较大时,氨去除率下降的原因是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,结构如图,下列说法正确的是( )
![]()
A.分子式为C3H6O3
B.分子中既有极性键也有非极性键
C.分子中σ键与π键个数之比为3:1
D.分子中碳原子的杂化方式全部为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度不变恒容的容器中H2、I2各1mol·L-1进行反应H2+ I2![]() 2HI,若某段时间内H2浓度由0.4mol·L-1降到0.24mol·L-1所需的反应时间为8s ,则反应起始时H2浓度由1mol·L-1降到0.4mol·L-1需的时间为
2HI,若某段时间内H2浓度由0.4mol·L-1降到0.24mol·L-1所需的反应时间为8s ,则反应起始时H2浓度由1mol·L-1降到0.4mol·L-1需的时间为
A. 小于30sB. 等于30sC. 大于30sD. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒![]() 在冶金、化工等领域有重要应用。实验室以含钒废料
在冶金、化工等领域有重要应用。实验室以含钒废料![]() 含
含![]() 、CuO、MnO、
、CuO、MnO、![]() 、
、![]() 、有机物
、有机物![]() 为原料制备
为原料制备![]() 的一种流程如下:
的一种流程如下:

已知:![]() 时,难溶电解质的溶度积常数如表所示:
时,难溶电解质的溶度积常数如表所示:
难溶电解质 |
|
|
|
|
|
|
|
(1)“焙烧”的目的是____________________________________________;
(2)“滤渣1”的用途为____________![]() 写出一种即可
写出一种即可![]() ;常温下,若“调pH”为7,
;常温下,若“调pH”为7,![]() 是否能沉淀完全:______
是否能沉淀完全:______![]() 填“是”或“否”
填“是”或“否”![]() ;
;![]() 溶液中离子浓度小于
溶液中离子浓度小于![]() 时,认为该离子沉淀完全
时,认为该离子沉淀完全![]()
(3)“沉锰”需将温度控制在![]() 左右,温度不能过高或过低的原因为_______________;
左右,温度不能过高或过低的原因为_______________;
(4)结晶所得的![]() 需进行水洗、干燥。证明
需进行水洗、干燥。证明![]() 已洗涤干净的实验操作及现象为_______________________;
已洗涤干净的实验操作及现象为_______________________;
(5)在煅烧![]() 生成
生成![]() 的过程中,固体残留率
的过程中,固体残留率![]() 随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是_________、____________。
随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是_________、____________。![]() 填写分子式
填写分子式![]()
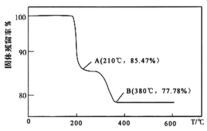
(6)为测定该产品的纯度,兴趣小组同学准确称取![]() 产品
产品![]() ,加入足量稀硫酸使其完全反应,生成
,加入足量稀硫酸使其完全反应,生成![]() ,并配成
,并配成![]() 溶液。取
溶液。取![]() 溶液用
溶液用![]() 的
的![]() 标准溶液滴定,滴定到终点时消耗标准液
标准溶液滴定,滴定到终点时消耗标准液![]() 。已知滴定过程中
。已知滴定过程中![]() 被氧化为
被氧化为![]() ,
,![]() 黄色
黄色![]() 被还原为
被还原为![]() 蓝色
蓝色![]() ,该反应的离子方程式为_____________;该产品的纯度为_________________。
,该反应的离子方程式为_____________;该产品的纯度为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com