
科目:高中化学 来源: 题型:选择题
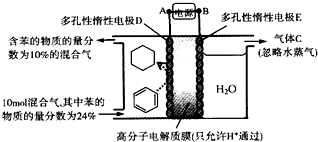
| A. | 多孔性惰性电极E为电解池的阴极 | |
| B. | 装置中气体C为氢气 | |
| C. | 由A至D,导线中电子转移方向为D→A | |
| D. | 装置中阴极的电极反应式为C6H6+6H++6e-═C6H12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
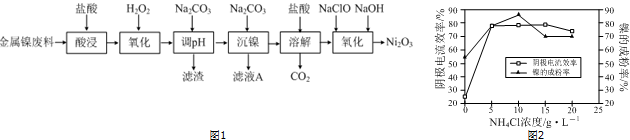
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
| 熔点/℃ | 122.4 | -114.1 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 212.6 |
| 密度/g•cm-3 | 1.2659 | 0.816 | 1.05 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
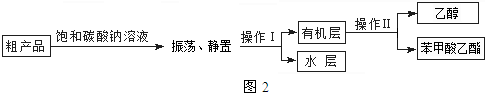
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径从小到大:V、Y、X、W、Z | |
| B. | X、Y、Z均只能与V形成共价化合物 | |
| C. | 气态氢化物稳定性:X<W,其中的原因是X-V键的键能小于W-V键 | |
| D. | Z与碳元素形成的一种常见化合物的分子式为ZC |
查看答案和解析>>
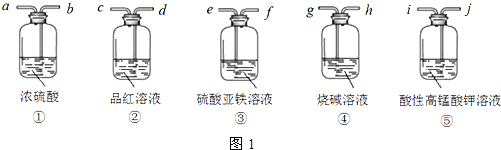
科目:高中化学 来源: 题型:实验题
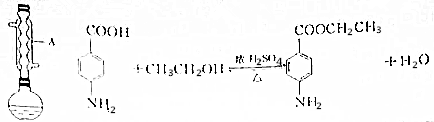
| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 340 | 微溶 |
| 苯佐卡因 | 165 | 1.039 | 90 | 172 | 难溶 |
| 乙醚 | 74 | 0.71 | -116.3 | 35 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导电太阳能电池使用的高纯硅在工业生产过程中实现了零污染 | |
| B. | 生物质能来源于植物及其加工产品贮存的能量,姑动物粪便不属于生物质能 | |
| C. | 通常用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性 | |
| D. | 金刚石、C60、纳米碳管都是碳的同素异形体,都属于原子晶体,金刚石、石墨碳纳米管、C60均有很高的熔沸点. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com