
【题目】电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,乳酸的摩尔质量为90g/moL;“A-”表示乳酸根离子)。则下列说法不正确的是

A.交换膜 I为只允许阳离子透过的阳离子交换膜
B.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C.电解过程中采取一定的措施可控制阴极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。设200mL 20g/L乳酸溶液通电一段时间后阴极上产生的H2在标准状况下的体积约为6.72L,则该溶液浓度上升为155g/L(溶液体积变化忽略不计)
D.浓缩室内溶液经过电解后pH降低
【答案】C
【解析】
A.根据图示,该电解池左室为阳极,右室为阴极,阳极上是氢氧根离子放电,阳极周围氢离子浓度增大,且氢离子从阳极通过交换膜 I进入浓缩室,则交换膜 I为只允许阳离子透过的阳离子交换膜,故A正确;
B.根据A项分析,阳极的电极反应式为:2H2O-4e-=O2↑+4H+,故B正确;
C.在阳极上发生电极反应:4OH4e═2H2O+O2↑,阴极上发生电极反应:2H++2e=H2↑,根据电极反应方程式,则有:2HA2H+1H2,电一段时间后阴极上产生的H2在标准状况下的体积约为6.72L,产生氢气的物质的量=![]() =0.03mol,则生成HA的物质的量=0.03mol×2=0.06mol,则电解后溶液中的乳酸的总质量=0.06mol×90g/moL +200×10-3L ×20g/L=9.4g,此时该溶液浓度=
=0.03mol,则生成HA的物质的量=0.03mol×2=0.06mol,则电解后溶液中的乳酸的总质量=0.06mol×90g/moL +200×10-3L ×20g/L=9.4g,此时该溶液浓度=![]() =47g/L,故C错误;
=47g/L,故C错误;
D.在电解池的阳极上是OH放电,所以c(H+)增大,并且H+从阳极通过阳离子交换膜进入浓缩室;根据电解原理,电解池中的阴离子移向阳极,即A通过阴离子交换膜(交换膜Ⅱ)从阴极进入浓缩室,这样:H++A═HA,乳酸浓度增大,酸性增强,pH降低,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】有下列各组物质:(A)O2和O3;(B)23592U和23892U;(C) CH3CH2CH2CH3和 ;(D)
;(D) 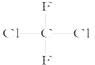 和
和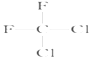 ;(E)甲烷和新戊烷。
;(E)甲烷和新戊烷。
(1)__________组两物质互为同位素;
(2)__________组两物质互为同素异形体;
(3)__________组两物质互为同系物;
(4)__________组两物质互为同分异构体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器中发生如下反应:N2O4(g)![]() 2NO2(g) △H>0,反应达到平衡时,下列说法不正确的是 ( )
2NO2(g) △H>0,反应达到平衡时,下列说法不正确的是 ( )
A.若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深
B.若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物质的百分含量不变
C.若体积不变,向容器中再加入一定量的N2O4,平衡向逆反应方向移动,再次平衡时N2O4的体积分数将增大
D.若体积不变,升高温度,再次平衡时体系颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为________mol。生成1 mol Cu3P时,参加反应的P的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应![]() 的
的![]() ,
,![]() 、
、![]() 分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为_____kJ。
分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为_____kJ。
(2)对于一般的化学反应aA+bB→P,反应物浓度和反应速率之间存在以下关系: v(单位mol·L-1·min-1)=k×c(A)x ×c(B)y,k称为速率常数,x称为反应物A的级数,y称为反应物B的级数,x+y称为反应的总级数。
① 对于反应H2(g)+I2(g)→2HI(g),速率表达式:v=k×c(H2)×c(I2),则反应总级数为________级。
② H2O2分解成水和氧气的反应是一级反应,反应速率常数k为0.0410 min-1,则过氧化氢分解一半的时间是__________min。(结果保留3位有效数字)(已知:一级反应物质浓度c=c0e-kt,c0为初始浓度,ln2=0.693)
(3)将等物质的量的I2和H2置于预先抽真空的特制1L密闭容器中,加热到1500 K,起始总压强为416kPa;体系达平衡,总压强为456kPa。体系中存在如下反应关系:
①I2(g)2I(g) Kp1 = 200 ΔH1
②I2(g)+ H2(g)2HI(g) Kp2 ΔH2
③HI(g)I(g)+ H(g) Kp3 ΔH3
④H2(g)2H(g) Kp4 ΔH4
(已知Kp3、 Kp4值很小,③、④反应忽略;Kp为以分压表示的平衡常数,以下计算结果均保留2位有效数字)
①ΔH2=_____________。(用含ΔH1、ΔH3、ΔH4的式子表示)
②1500K平衡体系中I(g)、H2(g)分压分别为______kPa、_______kPa、Kp2=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法正确的是
A. 简单离子半径R>W>Y>Z
B. 气态氢化物稳定性:HmW<HnR
C. Z2Y2电子式可表示为![]()
D. RY2和W2均有漂白性,将两者等物质的量混合溶于水,漂白性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中,合理的是
A.用已知浓度的NaOH溶液测定盐酸的浓度,酸式滴定管未用待装溶液润洗会造成测定结果偏高
B.![]() 溶液中:
溶液中:![]()
C.等体积等浓度的氢氧化钠与醋酸混合:![]()
D.![]() 相等的
相等的![]() 溶液、
溶液、![]() 溶液和
溶液和![]() 溶液:
溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是从海藻灰和智利硝石矿层中提取碘的主要反应:①2NaI+MnO2+3H2SO4===2NaHSO4+MnSO4+2H2O+I2 ;②2NaIO3+5NaHSO3===2Na2SO4+3NaHSO4+H2O+I2下列说法正确的是( )
A. 氧化性:MnO2>SO![]() >IO
>IO![]() >I2
>I2
B. I2在反应①中是还原产物,在反应②中是氧化产物
C. 反应①②中生成等量的I2时转移电子数之比为1∶5
D. NaHSO3溶液呈酸性,NaHSO3溶液中c(HSO![]() )>c(H2SO3)>c(SO
)>c(H2SO3)>c(SO![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com