
”¾ĢāÄæ”æµē½ā·ØŌŚ½šŹō¾«Į¶”¢±£»¤»·¾³”¢“¦Ąķ·ĻĖ®ÖŠĘš×ÅŹ®·ÖÖŲŅŖµÄ×÷ÓĆ”£
£Ø1£©ČēĶ¼ĪŖµē½ā¾«Į¶ŅųµÄŹ¾ŅāĶ¼£¬________(Ģīa»ņb)¼«ĪŖŗ¬ÓŠŌÓÖŹµÄ“ÖŅų£¬Čōb¼«ÓŠÉŁĮæŗģ×ŲÉ«ĘųĢåÉś³É£¬ŌņÉś³ÉøĆĘųĢåµÄµē¼«·“Ó¦Ź½ĪŖ______________________”£

£Ø2£©µē½ā·Ø“¦ĄķĖįŠŌŗ¬øõ·ĻĖ®(Ö÷ŅŖŗ¬ÓŠ![]() )Ź±£¬ŅŌĢś°å×÷Ņõ”¢Ńō¼«£¬“¦Ąķ¹ż³ĢÖŠ“ęŌŚ·“Ó¦
)Ź±£¬ŅŌĢś°å×÷Ņõ”¢Ńō¼«£¬“¦Ąķ¹ż³ĢÖŠ“ęŌŚ·“Ó¦![]() £«6Fe2£«£«14H£«
£«6Fe2£«£«14H£«![]() 2Cr3£«£«6Fe3£«£«7H2O£¬×īŗóCr3£«ŅŌCr(OH)3ŠĪŹ½³żČ„”£»Ų“šĻĀĮŠĪŹĢā£ŗ
2Cr3£«£«6Fe3£«£«7H2O£¬×īŗóCr3£«ŅŌCr(OH)3ŠĪŹ½³żČ„”£»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁŠ“³öµē¼«·“Ó¦Ź½£ŗŅõ¼«________________£¬Ńō¼«________________”£
¢Śµ±Éś³É1 mol Cr(OH)3Ź±£¬µēĀ·ÖŠ×ŖŅʵē×ÓµÄĪļÖŹµÄĮæÖĮÉŁĪŖ________mol”£
¢Ūµē½ā¹ż³ĢÖŠÓŠFe(OH)3³ĮµķÉś³É£¬ŌŅņŹĒ______________________________________”£
£Ø3£©µē½ā½µ½ā·ØæÉÓĆÓŚÖĪĄķĖ®ÖŠĻõĖįŃĪµÄĪŪČ¾”£µē½ā½µ½ā![]() µÄŌĄķČēĶ¼ĖłŹ¾”£
µÄŌĄķČēĶ¼ĖłŹ¾”£

¢ŁµēŌ“Õż¼«ĪŖ________(ĢīA»ņB)£¬Ņõ¼«·“Ó¦Ź½ĪŖ______________________”£
¢ŚČōµē½ā¹ż³ĢÖŠ×ŖŅĘĮĖ2 molµē×Ó£¬ŌņĤĮ½²ąµē½āŅŗµÄÖŹĮæ±ä»Æ²ī(¦¤m×󣦤mÓŅ)ĪŖ________g”£
”¾“š°ø”æ£Ø1£©a ![]() £«3e££«4H£«
£«3e££«4H£«![]() NO”ü£«2H2O»ņ
NO”ü£«2H2O»ņ![]() £«e££«2H£«
£«e££«2H£«![]() NO2”ü£«H2O
NO2”ü£«H2O
£Ø2£©¢Ł2H£«£«2e£![]() H2”ü Fe£2e£
H2”ü Fe£2e£![]() Fe2£« ¢Ś6 ¢ŪŃō¼«Éś³ÉµÄFe2£«±»ČÜŅŗÖŠµÄ
Fe2£« ¢Ś6 ¢ŪŃō¼«Éś³ÉµÄFe2£«±»ČÜŅŗÖŠµÄ![]() Ńõ»ÆFe3£«£¬Ņõ¼«H£«·Åµē£¬Ėę×ÅČÜŅŗÖŠµÄĖįŠŌĻĀ½µ£¬Ź¹Fe3£«µÄĖ®½āĘ½ŗāÓŅŅĘ£¬Éś³ÉFe(OH)3³Įµķ
Ńõ»ÆFe3£«£¬Ņõ¼«H£«·Åµē£¬Ėę×ÅČÜŅŗÖŠµÄĖįŠŌĻĀ½µ£¬Ź¹Fe3£«µÄĖ®½āĘ½ŗāÓŅŅĘ£¬Éś³ÉFe(OH)3³Įµķ
£Ø3£©¢ŁA 2![]() £«6H2O£«10e£
£«6H2O£«10e£![]() N2”ü£«12OH£ ¢Ś14.4
N2”ü£«12OH£ ¢Ś14.4
”¾½āĪö”æ±¾ĢāÖ÷ŅŖæ¼²éµē½ā³ŲŌĄķ”£
£Ø1£©“ÖŅų×÷Ńō¼«£¬ĖłŅŌa¼«ĪŖŗ¬ÓŠŌÓÖŹµÄ“ÖŅų£¬Čōb¼«ÓŠÉŁĮæŗģ×ŲÉ«ĘųĢåÉś³É£¬ŌņÉś³ÉøĆĘųĢåµÄµē¼«·“Ó¦Ź½ĪŖ![]() £«3e££«4H£«
£«3e££«4H£«![]() NO”ü£«2H2O»ņ
NO”ü£«2H2O»ņ![]() £«e££«2H£«
£«e££«2H£«![]() NO2”ü£«H2O”£
NO2”ü£«H2O”£
£Ø2£©¢Łµē¼«·“Ó¦Ź½£ŗŅõ¼«2H£«£«2e£![]() H2”ü£¬Ńō¼«Fe£2e£
H2”ü£¬Ńō¼«Fe£2e£![]() Fe2£«”£
Fe2£«”£
¢Śµ±Éś³É1 mol Cr(OH)3Ź±£¬ĻūŗÄ1 mol Cr3+£¬Éś³É1 mol Cr3+£¬ĻūŗÄ3 mol Fe2+£¬µēĀ·ÖŠ×ŖŅʵē×ÓµÄĪļÖŹµÄĮæÖĮÉŁĪŖ6 mol”£
¢Ūµē½ā¹ż³ĢÖŠÓŠFe(OH)3³ĮµķÉś³É£¬ŌŅņŹĒŃō¼«Éś³ÉµÄFe2£«±»ČÜŅŗÖŠµÄ![]() Ńõ»ÆFe3£«£¬Ņõ¼«H£«·Åµē£¬Ėę×ÅČÜŅŗÖŠµÄĖįŠŌĻĀ½µ£¬Ź¹Fe3£«µÄĖ®½āĘ½ŗāÓŅŅĘ£¬Éś³ÉFe(OH)3³Įµķ”£
Ńõ»ÆFe3£«£¬Ņõ¼«H£«·Åµē£¬Ėę×ÅČÜŅŗÖŠµÄĖįŠŌĻĀ½µ£¬Ź¹Fe3£«µÄĖ®½āĘ½ŗāÓŅŅĘ£¬Éś³ÉFe(OH)3³Įµķ”£
£Ø3£©Ag”ŖPt×÷Ņõ¼«£¬ĖłŅŌµēŌ“Õż¼«ĪŖA£¬![]() ³ÉĪŖĪŽĪŪČ¾µÄN2£¬Ņõ¼«·“Ó¦Ź½ĪŖ2
³ÉĪŖĪŽĪŪČ¾µÄN2£¬Ņõ¼«·“Ó¦Ź½ĪŖ2![]() £«6H2O£«10e£
£«6H2O£«10e£![]() N2”ü£«12OH£”£
N2”ü£«12OH£”£
¢Ś×ó²ąµÄŃō¼«·“Ó¦ĪŖ5H2O£10e£![]() 10H£«£«
10H£«£«![]() O2”ü£¬Čōµē½ā¹ż³ĢÖŠ×ŖŅĘĮĖ2 molµē×Ó£¬Ńō¼«Ēų¼õÉŁµÄÖŹĮæĪŖ
O2”ü£¬Čōµē½ā¹ż³ĢÖŠ×ŖŅĘĮĖ2 molµē×Ó£¬Ńō¼«Ēų¼õÉŁµÄÖŹĮæĪŖ![]() mol O2µÄÖŹĮ漓16 g£¬ÓŅ²ąµÄŅõ¼«Ēų¼õÉŁµÄÖŹĮæĪŖ
mol O2µÄÖŹĮ漓16 g£¬ÓŅ²ąµÄŅõ¼«Ēų¼õÉŁµÄÖŹĮæĪŖ![]() mol N2µÄÖŹĮ漓5.6 g£¬Ķ¬Ź±ŌŚŃō¼«ĒųÉś³ÉµÄ2 mol H£«ĶعżÖŹ×Ó½»»»Ä¤µ½“ļŅõ¼«Ēų£¬ĖłŅŌĤĮ½²ąµē½āŅŗµÄÖŹĮæ±ä»Æ²ī(¦¤m×󣦤mÓŅ)ĪŖ(16+2)(5.62) g=14.4 g”£
mol N2µÄÖŹĮ漓5.6 g£¬Ķ¬Ź±ŌŚŃō¼«ĒųÉś³ÉµÄ2 mol H£«ĶعżÖŹ×Ó½»»»Ä¤µ½“ļŅõ¼«Ēų£¬ĖłŅŌĤĮ½²ąµē½āŅŗµÄÖŹĮæ±ä»Æ²ī(¦¤m×󣦤mÓŅ)ĪŖ(16+2)(5.62) g=14.4 g”£


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(12 ·Ö)¼īŹ½ĀČ»ÆĶŹĒÖŲŅŖµÄĪŽ»śÉ±¾ś¼Į”£
£Ø1£©¼īŹ½ĀČ»ÆĶÓŠ¶ąÖÖÖʱø·½·Ø
¢Ł·½·Ø1: 45 ~ 50”ꏱ,ĻņCuClŠü×ĒŅŗÖŠ³ÖŠųĶØČėæÕĘųµĆµ½Cu2 (OH)2 Cl2”¤3H2O, øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_________________________”£
¢Ś·½·Ø2: ĻČÖʵĆCuCl2,ŌŁÓėŹÆ»ŅČ鷓Ӧɜ³É¼īŹ½ĀČ»ÆĶ”£CuÓėĻ”ŃĪĖįŌŚ³ÖŠųĶØČėæÕĘųµÄĢõ¼žĻĀ·“Ӧɜ³ÉCuCl2,Fe3+¶ŌøĆ·“Ó¦ÓŠ“ß»Æ×÷ÓĆ,Ęä“ß»ÆŌĄķČēĶ¼ĖłŹ¾”£ M'µÄ»ÆѧŹ½ĪŖ______”£

£Ø2£©¼īŹ½ĀČ»ÆĶÓŠ¶ąÖÖ×é³É,æɱķŹ¾ĪŖCua(OH)bClc”¤xH2O”£ ĪŖ²ā¶Øij¼īŹ½ĀČ»ÆĶµÄ×é³É, ½ųŠŠĻĀĮŠŹµŃé: ¢Ł³ĘȔѳʷ1.1160 g,ÓĆÉŁĮæĻ”HNO3ČܽāŗóÅä³É100.00 mLČÜŅŗA; ¢ŚČ”25. 00 mLČÜŅŗA,¼ÓČė×ćĮæAgNO3ČÜŅŗ,µĆAgCl 0. 1722 g;¢ŪĮķČ”25. 00 mLČÜŅŗA,µ÷½ŚpH 4 ~ 5,ÓĆÅضČĪŖ0.08000 mol”¤L-1µÄEDTA(Na2H2Y”¤2H2O)±ź×¼ČÜŅŗµĪ¶ØCu2+ (Ąė×Ó·½³ĢŹ½ĪŖCu2++ H2Y2-![]() CuY2-+2H+),µĪ¶ØÖĮÖÕµć,Ļūŗıź×¼ČÜŅŗ30.00 mL”£Ķعż¼ĘĖćČ·¶ØøĆѳʷµÄ»ÆѧŹ½(Š“³ö¼ĘĖć¹ż³Ģ)”£
CuY2-+2H+),µĪ¶ØÖĮÖÕµć,Ļūŗıź×¼ČÜŅŗ30.00 mL”£Ķعż¼ĘĖćČ·¶ØøĆѳʷµÄ»ÆѧŹ½(Š“³ö¼ĘĖć¹ż³Ģ)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹Ųµē½āÖŹČÜŅŗµÄŠšŹöÕżČ·µÄŹĒ
A. ŹŅĪĀĻĀ£¬pH¾łĪŖ4µÄH2SO4”¢(NH4)2SO4µÄČÜŅŗÖŠ£¬Ė®µÄµēĄė³Ģ¶ČĻąĶ¬
B. ŹŅĪĀŹ±£¬Ka£½1”Į10-5ÅضČĪŖ0.1 mol/LµÄHAČÜŅŗ£¬pH”Ö3
C. ŌŚ±„ŗĶAgCl”¢AgBrµÄ»ģŗĻČÜŅŗÖŠ¼ÓČėÉŁĮæAgNO3ČÜŅŗ Ōö“ó
Ōö“ó
D. 25”ꏱ£¬Ļņ20 mL 0.01 mol/LµÄ“×ĖįČÜŅŗÖŠµĪ¼Ó10 mL 0.01 mol/LµÄKOHČÜŅŗ£¬»ģŗĻČÜŅŗŗó³ŹĖįŠŌ£ŗc(K+) + c(H+)£¼c(CH3COOH) + c(OH-)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æīāŹĒŅ»ÖÖĻ”ÓŠ½šŹō£¬ĪŖČĖĢå¼°¶ÆÖ²Īļ±ŲŠėµÄĪ¢ĮæŌŖĖŲ£¬“潚ŹōīāŗĶīāŗĻ½š¾ßÓŠĒæ¶Č“ó”¢ÄĶøßĪĀ”¢ÄĶÄ„Ėš”¢ÄĶøÆŹ“µČ¶ąÖÖÓŠµć£¬¹ć·ŗÓ¦ÓĆÓŚŅ±½š”¢»śŠµ”¢»Æ¹¤”¢¾ü¹¤”¢µē¹āŌ“”¢Č󻬼Į”¢ŗ½æÕŗ½ĢģµČĮģÓņ”£Ä³»ÆѧŠĖȤŠ”×éŌŚŹµŃéŹŅÄ£ÄāĮĖ“ÓĶīā¾«æó£ØÖ÷ŅŖŗ¬ÓŠCu2S”¢MoS2£¬SiO2£¬P£¬AsµČ£©ÖŠĢįČ”·ÖĄėµĆµ½Ńõ»ÆīāµÄ¹ż³Ģ£ŗ

ŅŃÖŖ£ŗMoO3ŌŚ869.9KĪĀ¶ČĻĀæŖŹ¼Éż»Ŗ£¬¶ųµ½969.9ĪĀ¶ČĻĀ¼¤ĮŅÉż»Ŗ£¬ŌŚČÜŅŗÖŠŅŌH2MoO4ŠĪŹ½“ęŌŚ
£Ø1£©ĀĖŌü1µÄÖ÷ŅŖ³É·ÖĪŖ_________________________”£
£Ø2£©ĶīāæóÖŠµÄīāŌŖĖŲŌŚ¹żĮæµÄæÕĘųÖŠ£¬ÓŚŅ»¶ØĪĀ¶ČĻĀ£¬ŗÜČŻŅ×Ńõ»Æ³ÉMoO3£¬Ęä·½³ĢŹ½ĪŖ___________________________________£¬
±ŗÉÕ¹ż³ĢÖŠÓ¦æŲÖĘŌŚ800-870K×óÓŅ£¬ĘäŌŅņĪŖ____________________________”£
£Ø3£©¢ŁĻņĀĖŅŗ1ÖŠ¼ÓČėµÄĶŅÖÖĘ¼ĮÓŠ¶ąÖÖ£¬ČēĒč»ÆÄĘ£¬Ļņŗ¬ÖŲ½šŹōĄė×ÓµÄČÜŅŗÖŠĢķ¼ÓĒč»ÆÄĘ£¬»įĮ¢¼“Éś³É³Įµķ£¬µ«ŹĒČō¼ĢŠųĢķ¼ÓĒč»ÆÄĘ£¬³Įµķ¼ĢŠųÓėCN-·“Ó¦£¬Éś³É[Me(CN)4]2-ĪČ¶ØµÄÅäĄė×Ó£¬Ņņ“ĖŠčŅŖæŲÖĘĒč»ÆÄʵÄÓĆĮ棬ŹŌŠ“³öĻņĀĖŅŗÖŠ¼ÓČė¹żĮæĒč»ÆÄʵĥė×Ó·½³ĢŹ½_______________________________£»
¢ŚÓÉøÉĒč»ÆÄĘÓŠ¾ē¶¾£¬ĖłŅŌŠčŅŖ¶ŌŹ£ÓąµÄĒč»ÆÄĘ½ųŠŠ“¦Ąķ£¬Ķس£Ń”ÓĆÉīĘÆ°×·Ū»ņĘÆ°×ŅŗŌŚĖįŠŌĢõ¼žĻĀ½«ĘäŃõ»ÆĪŖĮ½ÖÖæÕĘųÖŠ³£¼ūĪŽ¶¾ĘųĢ壬ŹŌŠ“³öĘÆ°×ŅŗÓėĒč»ÆÄĘ·“Ó¦µÄĄė×Ó·½³ĢŹ½_____£»
¢Ū³żĒč»ÆÄĘĶā£¬³£ÓƵÄŅÖÖĘ¼Į»¹ÓŠŃĒĢśĒč»ÆÄĘ£¬Na4[Fe(CN)6]æÉÓėÖŲ½šŹōŃōĄė×Ó·“Ó¦£¬Éś³ÉČܶȻż½ĻŠ”µÄ³Įµķ£¬ŅŃÖŖCu2Fe(CN)6µÄKsp=1.00”Į10-16£»ĀĖŅŗÖŠµÄCu2+µÄÅضČĪŖĪŖ0.5mol/L”¢.µ±ČÜŅŗÖŠĄė×ÓÅØ¶ČŠ”ÓŚµČÓŚ1.00”Į10-16mol/LŹ±æÉČĻĪŖ³ĮµķĶźČ«£¬ŌņÓū“¦ĄķILĀĖŅŗµÄNa4[Fe(CN)6]Ģå»żĪŖ_________£ØĢå»ż±ä»ÆŗöĀŌ²»¼Ę£¬±£ĮōĮ½Ī»Š”Źż£©”£
£Ø4£©µ±NH3”ĆMoO3µČÓŚ»ņÉŌ“óÓŚ6”Ć7Ź±£¬æÉ“Ó°±ČÜŅŗÖŠ½į¾§³ö·Ö×ÓŹ½ĪŖ(NH4)6Mo7O24 4H2OµÄŃĪ”£Õō·¢ČÜŅŗ£Ø°Ń°±³żČ„£©»ņÖŠŗĶČÜŅŗ£Ø»ÆŗĻ²æ·Ö°±£©¶¼æÉŅŌ“ļµ½ÕāŅ»±ČĄż”£Ōņ²Ł×÷IĪŖ_______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷ĪļÖŹĖłŗ¬Ō×ÓŹżÄ棬°“Óɓ󵽊”Ė³ŠņÅÅĮŠµÄŹĒ£Ø £©
¢Ł0.5mol NH3 ¢Ś±ź×¼×“æöĻĀ 22.4L He ¢Ū4”ę9mL Ė® ¢Ü0.2mol H3PO4
A. ¢Ł¢Ü¢Ū¢Ś B. ¢Ü¢Ū¢Ś¢Ł C. ¢Ś¢Ū¢Ü¢Ł D. ¢Ł¢Ü¢Ś¢Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗ»¹ŌŠŌHSO3->I-£¬Ńõ»ÆŠŌIO3->I2”£ŌŚŗ¬3mol NaHSO3µÄČÜŅŗÖŠÖšµĪ¼ÓČĖKIO3ČÜŅŗ”£¼ÓČėKIO3ŗĶĪö³öI2µÄĪļÖŹµÄĮæµÄ¹ŲĻµĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
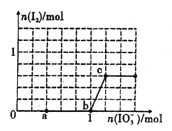
A. 0-a¶Ī·¢Éś·“Ó¦£ŗ3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b¶Ī¹²ĻūŗÄNaHSO3µÄĪļÖŹµÄĮæĪŖ1.8mol
C. b~c¶Ī·“Ó¦£ŗŃõ»Æ²śĪļĪŖI2
D. µ±ČÜŅŗÖŠI-ÓėI2µÄĪļÖŹµÄĮæÖ®±ČĪŖ5 : 1Ź±£¬¼ÓČėµÄKIO3ĪŖ1.lmol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹéŠ“ÕżČ·µÄŹĒ
A. Ģ¼ĖįÄĘČÜŅŗÓėŹÆ»ŅČé·“Ó¦£ŗCO32-+Ca2+=CaCO3”ż
B. ĻõĖįŅųČÜŅŗÓėŹ³ŃĪĖ®·“Ó¦£ŗAg++Cl-=AgCl”ż
C. ĻņNaOHČÜŅŗÖŠĶØČė¹żĮæµÄCO2£ŗ2OH-+CO2=CO32-+H2O
D. Ļņ·ŠĖ®ÖŠµĪ¼ÓFeCl3±„ŗĶČÜŅŗÖʱøFe(OH)3½ŗĢå£ŗFe3++3H2O![]() Fe(OH)3”ż+3H+
Fe(OH)3”ż+3H+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹµÄ·ÖĄąŗĻĄķµÄŹĒ£Ø””””£©
A. ·Ēµē½āÖŹ£ŗ°±Ęų”¢¾Ę¾«”¢ĀČĘų B. ¼ī£ŗÉÕ¼ī”¢“æ¼ī”¢ĒāŃõ»Æ±µ
C. »ģŗĻĪļ£ŗĘÆ°×·Ū”¢¼īŹÆ»Ņ”¢²£Į§ D. ĖįŠŌŃõ»ÆĪļ£ŗCO2”¢SiO2”¢NO2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢ¼¼°Ęä»ÆŗĻĪļŌŚÄÜŌ“”¢²ÄĮĻµČ·½Ćę¾ßÓŠ¹ć·ŗµÄÓĆĶ¾”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĢģČ»ĘųŹĒÄæĒ°Ó¦ÓĆ½ĻĪŖ¹ć·ŗµÄÄÜŌ“Ö®Ņ»£¬ĢģČ»ĘųÖŠ³żŗ¬Ö÷ŅŖ³É·Ö¼×ĶéĶā£¬»¹ŗ¬ÓŠŅŅĶ锢±ūĶéµČ£¬ŅŅĶéµÄµē×ÓŹ½ĪŖ ”£
£Ø2£©Ģ¼ĖįŗĶ²ŻĖį¾łĪŖ¶žŌŖČõĖį£¬ĘäµēĄė¾łĪŖ·Ö²½µēĄė£¬¶žÕߵĵēĄė³£ŹżČēĻĀ±ķ£ŗ
H2CO3 | H2C2O4 | |
K1 | 4.2”Į107 | 5.4”Į102 |
K2 | 5.6”Į1011 | 5.4”Į105 |
¢ŁĻņĢ¼ĖįÄĘČÜŅŗÖŠµĪ¼ÓÉŁĮæ²ŻĖįČÜŅŗĖł·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
¢ŚÅØ¶Č¾łĪŖ0.1 mol”¤L1µÄNa2CO3ČÜŅŗ”¢NaHCO3ČÜŅŗ”¢Na2C2O4ČÜŅŗ”¢NaHC2O4ČÜŅŗ£¬ĘäČÜŅŗÖŠH+ÅØ¶Č·Ö±š¼Ē×÷c1”¢c2”¢c3”¢c4”£ŌņĖÄÖÖČÜŅŗÖŠH+ÅضČÓɓ󵽊”µÄĖ³ŠņĪŖ ”£
£Ø3£©³£ĪĀŹ±£¬CŗĶCOµÄ±ź×¼Č¼ÉÕČČ·Ö±šĪŖ394.0 kJ”¤mol1”¢283.0 kJ”¤mol1£¬øĆĢõ¼žĻĀC×Ŗ»ÆĪŖCOµÄČČ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø4£©ĒāĘųŗĶŅ»Ńõ»ÆĢ¼ŌŚŅ»¶ØĢõ¼žĻĀæÉŗĻ³É¼×“¼£¬·“Ó¦ČēĻĀ£ŗ
2H2(g)+CO(g)![]() CH3OH(g) ¦¤H=Q kJ”¤mol1
CH3OH(g) ¦¤H=Q kJ”¤mol1
¢ŁøĆ·“Ó¦ŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄ»ÆŃ§Ę½ŗā³£Źż(K)ČēĻĀ±ķ£ŗ
ĪĀ¶Č/”ę | 250 | 300 | 350 |
K/L2”¤mol2 | 2.041 | 0.270 | 0.012 |
ÓÉ“ĖæÉÅŠ¶ĻQ (Ń”Ģī”° >”±»ņ”°<”±)0”£
¢ŚŅ»¶ØĪĀ¶ČĻĀ£¬½«6 mol H2ŗĶ2 mol CO³äČėĢå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ£¬10 min·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬“ĖŹ±²āµĆc(CO)=0.2 mol”¤L1£¬øĆĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżK= £¬0~10 minÄŚ·“Ó¦ĖŁĀŹv(CH3OH)= ”£
¢ŪŌŚĮ½øöĆܱÕČŻĘ÷ÖŠ·Ö±š¶¼³äČė20 mol H2ŗĶ10 mol CO£¬²āµĆŅ»Ńõ»ÆĢ¼µÄĘ½ŗā×Ŗ»ÆĀŹĖęĪĀ¶Č(T)”¢Ń¹Ēæ(p)µÄ±ä»ÆČēĶ¼ĖłŹ¾£ŗ

A”¢BĮ½µćµÄŃ¹Ēæ“󊔹ŲĻµ£ŗp1 (Ń”Ģī”° >”±”¢”°=”±»ņ”°<”±)p2”£ČōAµć¶ŌӦȯĘ÷µÄČŻ»żĪŖ20 L£¬ŌņBµć¶ŌӦȯĘ÷µÄČŻ»żĪŖ L”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com