
| A、4 | B、3 | C、2 | D、1 |
| 1.5g |
| 40g/mol |
| 1.6g |
| 32g/mol |
| 1.5g |
| 40g/mol |
| 1.6g |
| 32g/mol |
|


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
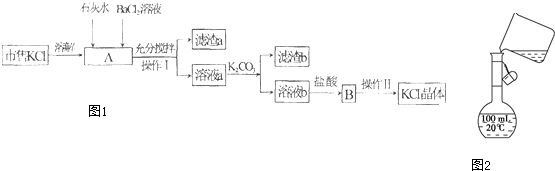
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12 | B、13 | C、14 | D、15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 |
| B、工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
| C、Fe3O4俗称铁红,常做红色油漆和涂料 |
| D、燃料电池的燃料都在负极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滑石粉属于无机硅酸盐类物质,滑石粉的组成可表示为3MgO?4SiO2?H2O |
| B、次氯酸钠、石灰、明矾可作消毒杀菌剂;碳酸钡俗称“钡餐”,是一种医疗药品 |
| C、水结冰时体积膨胀,密度减小,是因为水分子大范围以氢键相连,形成疏松晶体 |
| D、毛、发等的主要成分都是蛋白质,蛋白质水解的最终产物是氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳的质量分数相同 |
| B、固态时均为分子晶体 |
| C、一定条件下能与H2发生加成反应,就一定能使KMnO4酸性溶液褪色 |
| D、C8H8可能含有苯环结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,28g氮气含有的核外电子数为10 NA |
| B、1mol铜单质被还原为1molCu2+时转移电子数为2NA个 |
| C、在标准状况下,以任意比例混合的CH4与CO2 的混合物22.4L,所含有的分子数为NA |
| D、1mol石墨中含有2NA个C-C键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
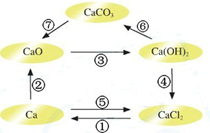 电解熔融氯化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按如图箭头所表示的物质间可能发生的转化,分析下列说法中正确的是( )
电解熔融氯化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按如图箭头所表示的物质间可能发生的转化,分析下列说法中正确的是( )| A、CaO、Ca(OH)2、CaCO3都含有氧元素,所以CaO、Ca(OH)2、CaCO3都属于氧化物 |
| B、电解熔融氯化钙得到金属钙和氯气的反应既是氧化还原反应又是化合反应 |
| C、虽然碳酸钙的水溶液不导电,但碳酸钙是电解质 |
| D、工业上以氯气和石灰水为原料通过反应④生产漂白粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com