
A、B属于短周期元素,能以化学键结合成分子式为AB2型的化合物,则B、A元素不可能分别属于周期表中的族数是( )
A.ⅤA和ⅠA族 B.ⅥA和ⅤA族
C.ⅥA和ⅣA族 D.ⅦA和ⅡA族
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A,A和D可形成气态化合物DA、DA2;A、B、D可组成离子晶体,该晶体的化学式为B4A3D2,其水溶液呈弱酸性,B和D可形成一种易溶于水的碱性气体X,B和C可形成极易溶于水的酸性气体Y,已知X分子和B2A分子中的电子数相等,Y分子的电子数与最简式为BA的化合物分子的电子数相等。请回答:
(1)写出四种元素的符号:A ,B ,C ,D 。
(2)B4A3D2的化学式为 ,所含化学键类型有 。
(3)已知液态X和B2A相似,也可以发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为 。
(4)最简式为BA的液体能使酸性KMnO4溶液褪色,写出相应的离子方程式
。
(5)最简式为BA的液体被称为绿色氧化剂的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:H2(g)+I2(g)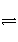
 2HI(g)。在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图所示的正确判断是( )
2HI(g)。在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图所示的正确判断是( )
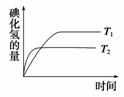
A.T1>T2,ΔH>0 B.T1>T2,ΔH<0
C.T1<T2,ΔH>0 D.T1<T2,ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外小组用下图装置制取溴苯并探究该反应的类型。先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。
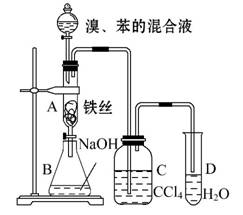
(1)写出A中反应的化学方程式: 。
此反应的类型为 。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是
。
(3)C中盛放CCl4的作用是 。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表(只答出一种即可)。
| 向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
| 方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断氧化银是( )
A. 负极,并被氧化
B. 正极,并被还原
C. 负极,并被还原
D. 正极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的乙醇、乙二醇、甘油,分别与足量金属钠作用,生成等物质的量的H2,则乙醇、乙二醇、甘油物质的量之比为( )
A.6:3:2 B.1:2:3 C.3:2:1 D.4:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O===O | P===O |
| 键能/kJ·mol-1 | 172 | 335 | 498 | X |
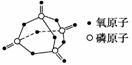
已知白磷的燃烧热为-2 378.0 kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=____________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:
C(石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1③
则由C(石墨)和H2(g)反应生成1 mol C2H2(g)的焓变为____________。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量。已知单质碳的燃烧热为y kJ·mol-1,则1 mol C与O2反应生成CO的反应热ΔH为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com