
 如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应,X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应,X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )| A、反应速率:v(B)>v(A) |
| B、A容器中X的转化率为80% |
| C、平衡时Y体积分数:A<B |
| D、打开活塞K重新达平衡VA=2.2aL |
| 8.4mol |
| 2mol |


科目:高中化学 来源: 题型:
| A、Mg2+、Fe3+、Cl-、OH- |
| B、Fe2+、SO42-、H+、NO3- |
| C、Ba2+、HCO3-、Cl-、Na+ |
| D、K+、NH4+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 | B、氢氧化钠 |
| C、氨气 | D、氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
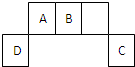 短周期元素A、B、C、D在周期表中位置如图所示,其中元素D原子最外层有3个电子.
短周期元素A、B、C、D在周期表中位置如图所示,其中元素D原子最外层有3个电子.| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1,2,3,-三甲基苯 |
| B、丙烷 |
| C、异丙醇 |
| D、甲酸丁酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成物的浓度一定增大 |
| B、平衡常数一定增大 |
| C、反应物的浓度一定降低 |
| D、正反应速率一定大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
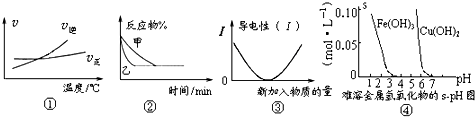
| A、根据图①可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H>0 |
| B、图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 |
| C、图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D、根据图④,若要除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,至pH=4左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低汽油的消耗.
第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低汽油的消耗.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2 |
| B、KMnO4 |
| C、Cl2 |
| D、FeCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com