
| A、能跟强碱溶液反应的氧化物就是酸性氧化物 |
| B、酸性氧化物都可以与水反应可生成酸 |
| C、金属氧化物不一定是碱性氧化物 |
| D、不能跟酸反应的氧化物一定能和碱反应 |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2LCO和N2混合气体中含有的分子数是0.5NA |
| B、在铁参与的反应中,5.6g铁完全反应失去的电子数一定为0.3NA |
| C、1molNa2O和1molNa2O2中,含阴离子的数目均为NA |
| D、常温下,pH=12的1L氨水中含有的NH3?H2O分子数是0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2=Cu+Cl2↑ |
| B、Na2CO3=2Na++CO32- |
| C、H2SO4=2H++S6++4O2- |
| D、Ba(OH)2=Ba+2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+=H2O+BaCO3↓ |
| C、Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| D、用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水变浑浊 |
| B、用四氯化碳去圆珠笔油渍 |
| C、烹调鱼时加入少量料酒和食醋可以减少腥味、增加香味 |
| D、在燃料煤中添加氧化钙以减少二氧化硫的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
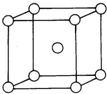 已知U、V、W、X、Y、Z均为元素周期表中前36号元素,且原子序数依次增大.U、V、W和X、Y分别为同一周期的主族元素,V原子p能级电子总数与s能级电子总数相等.U、Z原子中未成对电子数是同周期中最多的,且基态Z原子核外电子数是基态V原子核外电子数的3倍.X和Y原子的第一至第四电离能如表所示:
已知U、V、W、X、Y、Z均为元素周期表中前36号元素,且原子序数依次增大.U、V、W和X、Y分别为同一周期的主族元素,V原子p能级电子总数与s能级电子总数相等.U、Z原子中未成对电子数是同周期中最多的,且基态Z原子核外电子数是基态V原子核外电子数的3倍.X和Y原子的第一至第四电离能如表所示:| 电离能/kJ/mol | I1 | I2 | I3 | I4 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 578 | 1817 | 2745 | 11575 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 |
| Cr | 653 | 1592 | 2987 |
| Q | 759 | 1561 | 2957 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 相关信息 |
| W | W的基态原子核外3个能级上有电子,且每个能级上的电子数相等. |
| X | X原子核外L层电子数为奇数 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z在同周期元素的简单离子中半径最小 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com