
【题目】如图所示是探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法中不正确的是( )
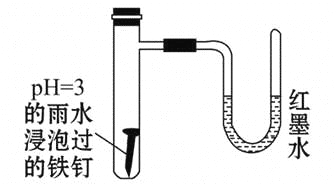
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
D.析氢腐蚀的总反应式为2Fe+O2+2H2O=2Fe(OH)2
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】铁是地壳中含量非常丰富的元素,金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参加的两个反应的化学方程式: ________________。
(2)写出赤铁矿被![]() 还原成铁的化学方程式:__________________________。
还原成铁的化学方程式:__________________________。
(3)实验室中可用![]() 还原
还原![]() ,在加热
,在加热![]() 前应先_________,否则可能发生________现象;未反应完的
前应先_________,否则可能发生________现象;未反应完的![]() ___________(填“能”或“不能”)排放到大气中,应做________处理。
___________(填“能”或“不能”)排放到大气中,应做________处理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅或多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。请回答下列问题:
(1)基态硒原子的价电子排布式为___;H2O的沸点高于H2Se的沸点(-42℃),其原因是___。
(2)已知GaCl3晶体熔点为77.9℃,沸点为201.3℃,GaCl3品体类型为____。
(3)Na3AsO4中阴离子的空间构型为_____,As原子采取_____杂化。
(4)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:_____。
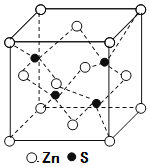
(5)锌与铜位于同一周期。硫化锌的晶胞结构如图所示,S2-周围等距离且最近的Zn2+个数为____;若晶胞边长为dpm,则硫化锌的密度为____g·cm-3(不必简化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准浓度氢氧化钠的溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( )
①碱式滴定管用蒸馏水洗净后未用标准溶液润洗
②锥形瓶中盛有少量蒸馏水,再加待测液
③酸式滴定用蒸馏水洗净后,未用盐酸润洗
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑤滴定后观察碱式滴定管读数时,俯视刻度线
A.①④B.①③C.②③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下:

请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6g H2O;E蒸气的密度标准状况下约为2.68g/L,则E的分子式为____________。
(2)A为一取代芳香烃,B中含有一个甲基。由B生成C的化学方程式为___________________。
(3)由B生成D、由C生成D的反应条件分别是________、________。
(4)由A生成B、由D生成G的反应类型分别是________、________。
(5)F存在于栀子香油中,其结构简式为_________________________。
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有________种,其中核磁共振氢谱有两组峰,且峰面积比为1∶1的是____________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水提取镁的主要步骤如下:
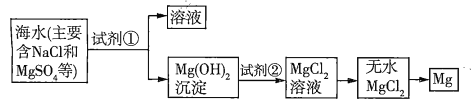
(1)关于加入试剂①作沉淀剂,有以下方法,请完成下列问题。
方法 | 是否合理 | 简述理由 |
方法:高温加热蒸发海水后,再加入沉淀剂 | a | b |
你认为合理的其他方法是c |
a. _____________;
b.____________;
c.____________。
(2)框图中加入的试剂①应该是_______(填物质名称),加入试剂②的溶质是_______(填化学式)。工业上由无水![]() 制取镁的化学方程式为___________。
制取镁的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态Cr原子中,电子占据最高能层的符号为________,该能层上具有的原子轨道数为________,电子数为________。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?________(填“是”或“否”),原因是_______________________________(如果前一问填“是”,此问可以不答)。
(3)镓与第ⅤA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表As原子)。在GaAs晶体中,每个Ga原子与________个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为________。
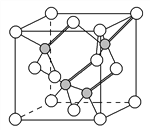
(4)与As同主族的短周期元素是N、P、AsH3中心原子杂化的类型________;一定压强下将AsH3和NH3、PH3的混合气体降温时首先液化的是________,理由是________________________。
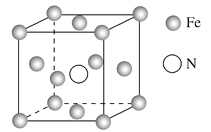
(5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,阿伏加德罗常数的值为NA,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:
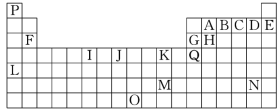
(1)I的最高化合价为________,K的元素名称为________。
(2)基态时Q元素原子的电子排布式_________________________________,J元素原子的外围电子排布式______________________。
(3)下列对比正确的是________。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是________。
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b.O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为________。
(6)元素B和C的气态氢化物热稳定性较强的是________(填化学式)。
(7)K的常见离子和B的最简单氢化物形成的配离子的名称为________,其水溶液颜色为________。Ag和元素K同族,且在K的下一周期,则Ag元素的原子序数为________,Ag也可以和B的最简单氢化物形成配离子,配位数为2,该配离子的符号为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是______________________________________________。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪去,有白色沉淀A产生。
① 针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:

请回答:
Ⅰ. 根据白色沉淀B是__________________(填化学式),判断沉淀A中一定存在CuSCN。
Ⅱ. 仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:_______________________________________________________。
Ⅲ. 向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是________________(填化学式)。
根据以上实验,证明A仅为CuSCN。
② 进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_______Cu2+ + _______SCN![]() = _______CuSCN↓ + _______ (SCN)2
= _______CuSCN↓ + _______ (SCN)2
③ 结合上述过程以及Fe(SCN)3 Fe3+ + 3SCN![]() 的平衡,分析(2)中溶液红色褪去的原因:_________________。
的平衡,分析(2)中溶液红色褪去的原因:_________________。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com