
【题目】大气、水体污染的治理是化学工作者研究的重要课题,燃煤的烟道气和汽车尾气是造成雾霾天气污染的原因之一。
(1)用CH4催化还原氮氧化物,已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1= a kJ/mol,欲计算反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(1)的焓变△H2,则还需要查找某化合反应的焓变△H3,该化合反应中各物质化学计量数之比为最简整数比时△H3=bkJ/mol,则该化合反应的热化学方程式为____________________。据此计算出△H2=__________kJ/mol(用含a和b的式子表示)。
(2)汽车尾气转化的反应之一:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H=-746.5kJ/mol。在某温度时,可按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表:
N2(g)+2CO2(g) △H=-746.5kJ/mol。在某温度时,可按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率υ(N2)=______________________________。
②在该温度下,反应的平衡常数K=___________(只写出计算结果)。
③对于该可逆反应,通过综合分析以上信息,至少可以说明___________(填字母)。
A.该反应的反应物混合后很不稳定
B.在催化剂的作用下,该反应一旦发生将在较短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)通过调节溶液pH,在弱碱性条件下,用漂白粉溶液可将废水中的CN-转化为碳酸盐和N2而除去。写出该反应的离子方程式为______________________。
(4)废水中的重金属离子通常用沉淀法除去。已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,国家规定的排放标淮:镍低于1.1×10-5mol·L-1,铜低于7.8×10-5mol·L-l。则需要控制溶液中S2-的浓度不低于__mol·L-1。
【答案】N2(g)+O2(g)=2NO(g) △H3=bkJ/mol a-2b 1.875×10-4mol/(Ls) 5000 BCD 2CN-+5ClO-+2OH-+2Ca2+=2CaCO3↓+N2↑+5Cl-+H2O 1×10-16
【解析】
(1)根据盖斯定律进行计算;
(2) ①根据表格数据先计算出υ(NO),然后根据速率之比和系数成正比计算出υ(N2);
②计算出平衡以后各物质的浓度,根据平衡常数计算公式进行计算;
③根据影响化学反应速率的因素进行分析,根据G=H-TS<0反应能够自发进行进行分析;根据平衡常数定义进行分析;
(3) 漂白粉有效成分为次氯酸钙,次氯酸根离子具有氧化性,能够把CN-氧化为碳酸盐和氮气,据此写出反应方程式;
(4)根据 Ni2+达到排放标准时,c(S2-)×c(Ni2+)≤Ksp(NiS),从而计算出S2-的浓度的最小值。
(1)①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=a kJ/mol,
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(1) △H2,
根据盖斯定律可知,1/2[②-①]可得2NO(g)-O2(g)=N2(g),1/2[△H2-△H1], 根据题意可知,N2(g)+ O2(g)=2NO(g) △H3=-1/2[△H2-△H1]=bkJ/mol;△H2=(a-2b)kJ/mol;
综上所述,本题答案是:N2(g)+ O2(g)=2NO(g) △H3=bkJ/mol,a-2b。
(2) ①从表格数据可知前2s内,c(NO)=(10-2.5)×10-4mol/L=7.5×10-4mol/L,υ(NO)=7.5×10-4mol/L /2s=3.75×10-4 mol/(Ls),根据速率之比和系数成正比可知,前2s内的平均反应速率υ(N2)=1/2υ(NO)= 1.875×10-4mol/(Ls);
综上所述,本题答案是:1.875×10-4mol/(Ls)。
②4s以后,反应达到平衡状态,平衡后各物质浓度分别为:c(NO)=1×10-4mol/L,c(CO)=2.7×10-3 mol/L,c(N2)=0.5×(10-1)×10-4 mol/L =4.5×10-4mol/L,c(CO2)=(10-1) ×10-4 mol/L =9×10-4mol/L,K=c2(CO2)c(N2)/[c2(CO)c2(NO)]=(9×10-4)2×4.5×10-4/[(1×10-4)2×(2.7×10-3 )2]=5000;
综上所述,本题答案是:5000。
③该反应在催化剂存在时反应速率很快,所以反应一旦发生将在很短的时间内完成,但不能说明NO和CO混合后很不稳定,A项错误、B项正确;该反应的化学平衡常数大,所以反应达到平衡时至少有一种反应物的百分含量较小,C项正确;该反应是一个熵减的放热反应,所以一定条件下能自发进行,D项正确;使用高效催化剂能大大加快化学反应速率,故E项错误。
综上所述,本题选BCD。
(3) 漂白粉有效成分为次氯酸钙,次氯酸根离子具有氧化性,能够把CN-氧化为碳酸盐和氮气,该反应的离子方程式为2CN-+5ClO-+2OH-+2Ca2+=2CaCO3↓+N2↑+5Cl-+H2O;
综上所述,本题答案是:2CN-+5ClO-+2OH-+2Ca2+=2CaCO3↓+N2↑+5Cl-+H2O。
(4) Ni2+达到排放标准时,c(S2-)×c(Ni2+)≤Ksp(NiS),所以c(S2-)≥Ksp(NiS)÷c(Ni2+)mol/L=1.1×10-21÷(1.1×10-5)mol/L=10-16mol/L,因为Ksp(CuS)远小于Ksp(NiS),所以此时Cu2+肯定达到排放标准,则需要控制溶液中S2-的浓度不低于10-16mol/L。
综上所述,本题答案是:10-16。


科目:高中化学 来源: 题型:
【题目】(1)基态Fe2+的核外电子排布式为_________________________________。
(2)元素的第三电离能I3:Fe______Mn(填“>”或:“<”)。
(3)H2O的沸点比H2S高的原因是_______________________________________。
(4)亚西尔阿拉法特的死因被怀疑是钋—210中毒。钋与氧同族,基态钋原子有________个未成对电子。钋沉积在铍(9Be)上用作原子弹的中子源。铍的氯化物BeCl2室温下为雪白色易升华的固体,能溶于水和部分有机溶剂。室温下BeCl2固体属于__________晶体,500-600°C时,氯化铍以二聚体的形式存在,其二聚体的结构式为__________________(配位键用“→”表示)。
(5)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
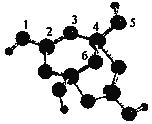
①在Xm-中,数字标号为4的硼原子的轨道杂化类型为___________;m=_______填数字)。
②若硼砂的式量为382 , 则其化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
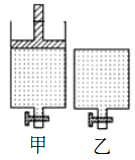
【题目】下刎有关实验装置、操作,不能实现相应实验目的的是

A. 装置甲可用酸性KMnO4溶液滴定FeSO4溶液
B. 用装置乙进行实验时若逐滴滴加AgNO3溶液先出现黄色沉淀,可说明 Ksp(AgCl)>Ksp(AgI)
C. 装置丙可用于收集氢气
D. 装置丁可用于 NaOH溶液除去溴苯中单质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下的可逆反应:A(s)+2B(g) ![]() 2C(g)+D(g) △H<0,在甲容器充入2molA、2molB并保持压强不变,乙容器充入2molC、 1mol D并保持体积不变,起始时甲、乙两容器气体体积相等。为使平衡时两容器中B的浓度相等,下列措施不可行的是
2C(g)+D(g) △H<0,在甲容器充入2molA、2molB并保持压强不变,乙容器充入2molC、 1mol D并保持体积不变,起始时甲、乙两容器气体体积相等。为使平衡时两容器中B的浓度相等,下列措施不可行的是
A. 乙容器中分离出一定量的D气体
B. 向甲谷器中再充入一定量的B气体
C. 将甲的活塞往下压至反应前的位置
D. 适当降低乙容器的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式______________________________、________________________________。
(2)甲水浴的作用是_________________________________________;乙水浴的作用是_________________________________________。
(3)反应进行一段时间后,干试管a中能收集到不同的物质,它们是________。集气瓶中收集到的气体的主要成分是________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有______。要除去该物质,可在混合液中加入____________(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,几种物质的pH和浓度如下表所示.回答下列问题:

(1)c1___(填“>“'<C”或“=“)c2.
(2)溶液中水的电离程度②___(填“>“'<”或“=“)③.
(3)分别加水稀释10倍,稀释后四种溶液的pH由大到小的顺序为___(填序号).
(4)①溶液与④溶液等体积混合,溶液的pH___(填“>“'<“或“=”,下同)7;用④溶液滴定①荣而言,滴定过程中不可能出现的结果是___
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) B.c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.c(Cl-)>c(NH4+)>c(OH-)>c(H+) D.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
E.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PSCl3 、S2Cl2、SOCl2等含硫化合物用途非常广泛。
(1)PSCl3(结构式为: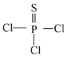 )中磷的化合价为______。
)中磷的化合价为______。
(2)S2Cl2分子中各原子均满足8电子结构,画出S2Cl2的结构式:_____。
(3)能说明同周期的相邻元素S的非金属性比Cl弱的事实是_____(填标号)。
A.H2SO3的酸性比HClO3的弱
B.气态H2S的热稳定性比HCl的弱
C.Cl2通入Na2S溶液可发生反应:Cl2+S2-=2Cl-+S↓
D.SO2是常见的还原剂,ClO2是常见的氧化剂
(4)SOCl2(沸点78.8℃)可用作锂电池的非水电解质及有机合成的氯化剂等。
①SOCl2可由S2Cl2、SO2及Cl2在催化剂和180~200℃时,通过发生化合反应制得,该反应的化学方程式为_____。
②Li/SOCl2电池的电池反应为:4Li+2SOCl2→4LiCl↓+S+SO2。电池工作时,下列说法正确的是____(填标号)。
A.Li电极的质量不变 B.电能转变为化学能
C.负极发生氧化反应 D.正极上SOCl2被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 2CH2=CH2+O2![]() 是理想的原子经济,原子利用率为100%
是理想的原子经济,原子利用率为100%
B. 石油分馏制得汽油、煤油、柴油等产品
C. 煤干馏的产品很多,属于物理变化
D. 煤的气化主要反应是C(s)+H2O(g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com