
分析 (1)0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.4mol,根据原子守恒可知,该烃的分子式为C4H8;
(2)该烃的分子式为C4H8,不饱和度为1,而该烃能使溴水褪色,说明分子中含有1个C=C键,与HBr在一定条件的加成产物只有一种,说明该烯烃是碳碳双键高度对称;
(3)若烃A与某烷组成同温同压下与乙炔密度相同的混合气体,即烃A与某烷平均相对分子量为26,所以烷烃的相对分子量小于26,则烷烃是甲烷,体积分数之比等于物质的量之比.
解答 解:(1)0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,根据原子守恒可知,该烃的分子中N(C)=$\frac{0.4mol}{0.1mol}$=4,N(H)=$\frac{0.4mol×2}{0.1mol}$=8,该烃的分子式为:C4H8 ,故答案为:C4H8;
(2)该烃的分子式为C4H8,不饱和度为1,而该烃能使溴水褪色,说明分子中含有1个C=C键,与HBr在一定条件的加成产物只有一种,说明该烯烃是碳碳双键高度对称,所以分子式为:CH3CH═CHCH3,故答案为:CH3CH═CHCH3;
(3)若烃A与某烷组成同温同压下与乙炔密度相同的混合气体,即烃A与某烷平均相对分子量为26,所以烷烃的相对分子量小于26,
①烷烃是甲烷,所以分子式为CH4,故答案为:CH4;
②设C4H8 的物质的量为xmol,甲烷的物质的量为ymol,所以$\frac{56x+16y}{x+y}$=26,则$\frac{x}{y}=\frac{1}{3}$,即烷烃在标准状况下所占的体积分数为:$\frac{3}{1+3}$×100%=75%,
答:该混合气体中烷烃在标准状况下所占的体积分数为75%.
点评 本题考查混合物的有关计算、阿伏伽德罗定律及推论,难度不大,理解平均相对分子质量的计算是关键,可以利用十字交叉法计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| J | |||
| R |
 ; 元素T最高价氧化物对应水化物化学式是Cl2O7.
; 元素T最高价氧化物对应水化物化学式是Cl2O7. ,含有共价键是极性键(填极性键或非极性键).
,含有共价键是极性键(填极性键或非极性键).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

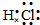 ,甲的组成元素的原子结构示意图
,甲的组成元素的原子结构示意图 ,能证明甲的组成元素非金属性很强的事实氟气和氢气在黑暗处能产生爆炸.(任举一例即可)
,能证明甲的组成元素非金属性很强的事实氟气和氢气在黑暗处能产生爆炸.(任举一例即可)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 | B. | 22mol | C. | 44g | D. | 44g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com