
【题目】金属铝用途广泛,工业上利用铝矾土矿(主要成分是Al2O3)制备金属铝。
(1)首先获得纯净的Al2O3,其工艺流程如下:
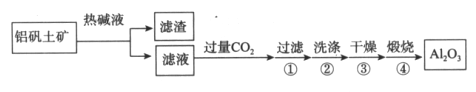
①滤液中通入过量CO2的反应离子方程式是________________。
②煅烧生成氧化铝的化学方程式是______________。
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以石墨衬里为阴极,石墨棒为阳极,进行电解。
①电解Al2O3能制备金属铝的原因是__________(填序号)。
a. Al2O3属于电解质
b. Al2O3属于离子化合物
c. Al2O3属于两性氧化物
d. Al2O3在熔融状态时能导电
②Al单质在_________极产生。
③阳极石墨棒需要不断补充,结合电极反应式,简述其原因是________________。
【答案】 AlO![]() +CO2+2H2O=HCO
+CO2+2H2O=HCO![]() +Al(OH)3↓ 2Al(OH)3
+Al(OH)3↓ 2Al(OH)3![]() Al2O3+3H2O abd 阴 阳极反应式是2O2--4e-=O2↑,高温条件下,生成的氧气与石墨反应,消耗阳极材料,所以需要补充
Al2O3+3H2O abd 阴 阳极反应式是2O2--4e-=O2↑,高温条件下,生成的氧气与石墨反应,消耗阳极材料,所以需要补充
【解析】(1)①铝矾土矿(主要成分是Al2O3)与热碱溶反应后滤液主要成分为偏铝酸盐,通入过量CO2的反应生成氢氧化铝和碳酸氢盐,反应的离子方程式为![]() +CO2+2H2O=
+CO2+2H2O=![]() +Al(OH)3↓;②煅烧生成氧化铝的化学方程式是2Al(OH)3
+Al(OH)3↓;②煅烧生成氧化铝的化学方程式是2Al(OH)3![]() Al2O3+3H2O;(2)①电解Al2O3能制备金属铝的原因是Al2O3属于离子化合物,属于电解质,在熔融状态时能导电;答案选abd;②铝离子在阴极得电子产生Al单质;③阳极反应式是2O2--4e-=O2↑,高温条件下,生成的氧气与石墨反应,消耗阳极材料,所以需要补充。
Al2O3+3H2O;(2)①电解Al2O3能制备金属铝的原因是Al2O3属于离子化合物,属于电解质,在熔融状态时能导电;答案选abd;②铝离子在阴极得电子产生Al单质;③阳极反应式是2O2--4e-=O2↑,高温条件下,生成的氧气与石墨反应,消耗阳极材料,所以需要补充。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】《有机化学基础》
(1) 分子中的官能团与有机化合物的性质密切相关。
①下列化合物中与![]() 互为同系物的是____(填字母)。
互为同系物的是____(填字母)。
a. ![]() b.
b. ![]() c.
c. ![]()
②下列化合物中,常温下能使酸性高锰酸钾溶液褪色的是____(填字母)。
a. CH3CH3 b. HC≡CH c. CH3COOH
③下列化合物中,能发生酯化反应的是____(填字母)。
a. CH3CH2Cl b. CH3CHO c. CH3CH2OH
(2) 化合物X(![]() )是一种合成液晶材料的化工原料。
)是一种合成液晶材料的化工原料。
①1 mol X在一定条件下最多能与____mol H2发生加成反应。
②X在酸性条件下水解可生成![]() 和________(用结构简式表示)。
和________(用结构简式表示)。
③![]() 分子中最多有____个碳原子共平面。
分子中最多有____个碳原子共平面。
(3) 化合物D是一种医药中间体,可通过下列方法合成。
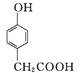 A
A![]()
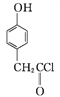 B
B ![]()
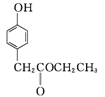 C
C ![]()
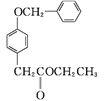 D
D
①A→B的反应类型为____。
②D中含氧官能团有____和____(填名称)。
③C→D的反应中有HCl生成,则M的结构简式为_______。
④E是A的一种同分异构体,E分子的核磁共振氢谱共有4个吸收峰,能发生银镜反应,能与FeCl3溶液发生显色反应。E的结构简式为___________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
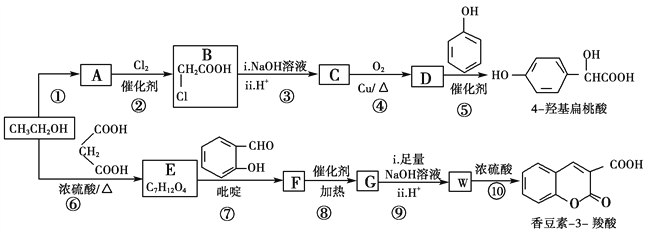
【题目】工业上以乙醇为原料经一系列反应可以得到4羟基扁桃酸和香豆素3羧酸,二者的合成路线如下(部分产物及条件未列出):
已知:
Ⅰ.RCOOR′+R″OH![]() RCOOR″+R′OH
RCOOR″+R′OH
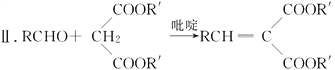
(R,R′,R″表示氢原子、烷基或芳基)
回答下列问题:
(1)反应②属于取代反应,则A中官能团的名称是________
(2)  的名称是________,反应⑤的反应类型为________。
的名称是________,反应⑤的反应类型为________。
(3)反应⑥的化学方程式是________________________________________。
(4)已知G分子中含有2个六元环。下列有关说法正确的是________(填标号)。
a.核磁共振仪可测出E有5种类型的氢原子
b.质谱仪可检测F的最大质荷比的值为236
c. G分子中的碳原子均可以共面
d.化合物W能发生加聚反应得到线型高分子化合物
(5)某芳香化合物Q是4羟基扁桃酸的同分异构体,具有下列特征:①苯环上只有3个取代基;②能发生水解反应和银镜反应;③1 mol Q最多能消耗3 mol NaOH。Q共有________种(不含立体异构)
(6)仔细观察由乙醇合成香豆素-3-羧酸的过程,结合相关信息,当乙醇与丙二酸的物质的量的比为_______时,只许3步即可完成合成路线。请写出合成路线_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO和足量C发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是

A. 增大压强或升高温度,NO转化率均增大
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时v正>v逆
D. 若状态B、C、D的压强分别为PB、PC、PD,则PC=PD>PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份100mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸体积之间的关系如图所示。下列说法正确的是
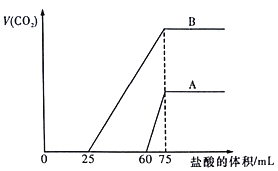
A. B曲线中消耗盐酸0<V(HCl)<25mL时发生的离子反应为: OH-+H+=H2O,H++CO32-=HCO3-
B. 原NaOH溶液的物质的量浓度为0.75mol/L
C. B曲线最终产生的CO2体积(标准状况下)为112mL
D. 加盐酸之前A溶液中的溶质是碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+。
+2H+。
②含铬元素的离子在溶液中的颜色:Cr2O![]() (橙色);CrO
(橙色);CrO![]() (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。

(1)i可证明反应Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+的正反应是__________(填“吸热”或“放热”)。
+2H+的正反应是__________(填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_________。
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的________(填“能”或“不能”),理由是____________。
(4)根据实验Ⅱ中不同现象,可以得出的结论是__________。
(5)继续实验

①解释溶液变黄的主要原因是________。
②溶液变绿色,该反应的离子方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A. 石墨电极上发生氧化反应 B. 通甲烷的电极反应式:CH4+4CO32--8e-=5CO2+2H2O
C. 通空气的电极反应式为O2+4e-=2O2- D. 甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源。实验室常用下列装置(夹持装置已略去)制备无水NiCl2。
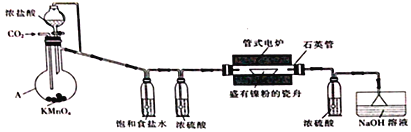
实验步骤如下:
I.按图示连接好装置,检查装置气密性后,先向装置中通入干燥的CO2。
II.约20min后,停止通入CO2,改为通儒Cl2并使装置中充满Cl2。
III.将电炉升温至750℃,在氯气流中加热约lh。
IV.在氯气流中冷却至室温后,再继续通入CO2约10min。
回答下列问题:
(1)仪器A的名称为_____________________________。
(2)步骤I中通入CO2的目的是___________________________。
(3)A中生成Cl2的离子方程式为______________________________________。
(4)判断步骤II中氧气已充满装置的现象是______________________________________。
(5)步骤IV中通入CO2的目的是______________,水槽中NaOH溶液的作用是_____________________。
(6)反应前石英管及瓷舟的总质量为m1、放入镍粉后石英管及瓷舟的总质量为m2,氧化反应后石英管及瓷舟的总质量为m3,则产品中n(Ni)/n(Cl)=________(填计算表达式)。
(7)实验室也可用NiCl2·6H2O与液态SOCl2混合加热制取无水NiCl2,其反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )

A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com