


 ;
; .
. 分析 A在碱性条件下水解生成B和C,B通入二氧化碳受生成C,C发生显色反应,则C为 、B为
、B为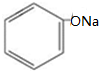 ,D为HOCH2C(OH)(CH3)CH2COONa,D酸化得到E,E为HOCH2C(OH)(CH3)CH2COOH,E分子式为C5H10O4,E分子式比F少2个H原子、1个O原子,所以E发生消去反应或酯化反应生成F,再结合题目分析解答.
,D为HOCH2C(OH)(CH3)CH2COONa,D酸化得到E,E为HOCH2C(OH)(CH3)CH2COOH,E分子式为C5H10O4,E分子式比F少2个H原子、1个O原子,所以E发生消去反应或酯化反应生成F,再结合题目分析解答.
解答 解:A在碱性条件下水解生成B和C,B通入二氧化碳受生成C,C发生显色反应,则C为 、B为
、B为 ,D为HOCH2C(OH)(CH3)CH2COONa,D酸化得到E,E为HOCH2C(OH)(CH3)CH2COOH,E分子式为C5H10O4,E分子式比F少2个H原子、1个O原子,所以E发生消去反应或酯化反应生成F,
,D为HOCH2C(OH)(CH3)CH2COONa,D酸化得到E,E为HOCH2C(OH)(CH3)CH2COOH,E分子式为C5H10O4,E分子式比F少2个H原子、1个O原子,所以E发生消去反应或酯化反应生成F,
(1)A分子中含氧官能团的名称为酯基和醇羟基,氯原子、水解生成的HCl及羧基、酚羟基都和NaOH反应,1molA最多可消耗3molNaOH,故答案为:醇羟基、酯基;3;
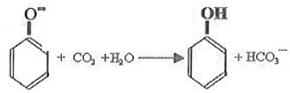
(2)B是苯酚钠,向苯酚钠中通入少量二氧化碳生成苯酚和碳酸氢钠,离子方程式为 ,
,
故答案为: ;
;
(3)E为HOCH2C(OH)(CH3)CH2COOH,E与O2在Ag催化作用下发生氧化反应生,该反应的化学方程式: ,
,
故答案为: ;
;
(4)F的分子式为C5H8O3,可能有多种结构,若F中含有一个五元环,则E发生酯化反应生成F,
E生成F的化学方程式: ;
;
若F不含甲基且能使溴水褪色,则E发生消去反应生成碳碳双键,F通过加聚反应生成的高分子化合物的结构简式: ,
,
故答案为: ;
; .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,根据A结构简式结合反应条件进行推断,正确判断各物质结构简式是解本题关键,注意:①A水解时-Cl也发生水解,A水解生成的酚羟基、HCl都和NaOH反应;②(3)中E发生催化氧化时手性碳原子上的羟基不能发生氧化反应,这两点为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 在Na2S稀溶液中:c (Na+)>c (S2-)>c (OH-)>c (H+)>c (HS-) | |
| B. | 在Na2C2O4稀溶液中:c (Na+)+c (H+)=c (OH-)+c (C2O42-)+c (HC2O4-) | |
| C. | 在含等物质的量的Na2CO3和NaHCO3的混合溶液中:3 c (Na+)=2[c (CO32-)+c (HCO3-)+c (H2CO3)] | |
| D. | 在NaHSO3稀溶液中:c (OH-)+c (SO32-)=c (H+)+c (H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自备购物袋,不用塑料方便袋,可以有效控制“白色污染” | |
| B. | 大力发展、推广可利用太阳能.风能的城市照明系统,能够减少温室气体的排放 | |
| C. | 将液电池深埋,可以避免其中的重金属污染 | |
| D. | 建立空调凝结水和屋面雨水收集系统,充分利用水资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,试回答下列各题:
,试回答下列各题: B.
B. C.
C. D.
D.



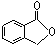
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠的水解反应:CH3COO-+H2O═CH3COOH+H2O | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2-+2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示,B离子均在晶胞体内,D的离子分占在晶胞顶点和面心.请回答下列问题.
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示,B离子均在晶胞体内,D的离子分占在晶胞顶点和面心.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | H2O2 | C. | Cl2 | D. | ClO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com