
【题目】某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
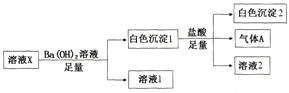
下列说法正确的是
A. 气体A可能是CO2或SO2
B. 溶液X中一定存在SO42-、HCO3-、Na+、Mg2+
C. 溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D. 分别在溶液1和溶液2中加入硝酸酸化的硝酸银溶液都能生成白色沉淀
【答案】B
【解析】由图示可知,溶液X中加入足量的氢氧化钡溶液后,出现白色沉淀,向白色沉淀中加入足量的盐酸,仍有白色沉淀并产生气体A,可知溶液X中一定含有SO42-,可能含有SO32-、HCO3-中一种或两种,则Fe3+一定存在,结合电荷守恒和离子的物质的量浓度均相同,可知一定不存在SO32-,A项错误;可知溶液X中一定含有SO42-、HCO3-,根据电荷守恒可知,还阳离子为Na+、Mg2+,B项正确;溶液X中一定不存在Fe3+,一定存在Na+和Mg2+,C项错误;溶液X中不存在Cl-,溶液1中加入硝酸酸化的硝酸银溶液都能无白色沉淀生成,溶液2中引入Cl-,加入硝酸酸化的硝酸银溶液都能生成白色沉淀,D项错误。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+Y2(g)![]() 2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1molL-1、0.3molL-1、0.2molL-1,反应达到平衡时,各物质浓度可能是 ( )
2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1molL-1、0.3molL-1、0.2molL-1,反应达到平衡时,各物质浓度可能是 ( )
A.c(X)=0.2molL-1 B.c(Y2)=0.35molL-1 C.c(Y2)=0.2molL-1 D.c(Z)=0.4molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),达到平衡,若其它条件不变,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法不正确的是( )
2CO(g)+2H2(g),达到平衡,若其它条件不变,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法不正确的是( )
A.正、逆反应速率都加快 B.氢气的浓度与原平衡比减少
C.甲烷的物质的量增加 D.重新平衡时c(CO2) /c(CO)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 将少量SO2气体通入Ba(OH)2溶液中,有白色沉淀生成
B. 将SO2气体通入BaCl2溶液中,有白色沉淀生成
C. 将SO2气体通入用硝酸酸化过的BaCl2溶液中,有白色沉淀生成
D. 将硝酸酸化的BaCl2溶液加入某溶液中有白色沉淀产生,不能判断该溶液中一定存在SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(6)实验时所用盐酸及NaOH溶液的密度均为1g/cm3,生成溶液的比热容C=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式:△H=____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(含80%~90%的Ca(OH)2,其余为焦炭等不溶物)为原料制备KClO3的实验过程如下:
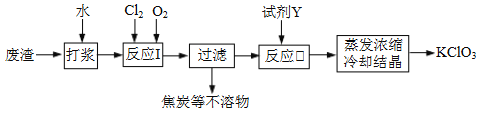
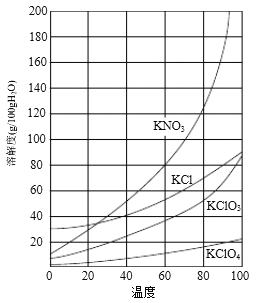
几种物质的溶解度如下图:
⑴反应I的目的是制备Ca(ClO3)2,写出该反应的化学方程式:_____________;在通入Cl2和O2比例、废渣量均一定的条件下,为使Cl2转化完全,可采取的合理措施是____________。
⑵若过滤时滤液出现浑浊,其可能的原因是_____________(填序号)。
A.漏斗中液面高于滤纸边缘 B.滤纸已破损 C.滤纸未紧贴漏斗内壁
⑶所加试剂Y选用KCl而不用KNO3的原因是_____________。
⑷已知:4KClO3![]() 3KClO4 +KCl;2KClO3
3KClO4 +KCl;2KClO3![]() 2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
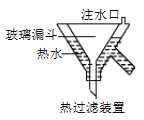
①热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长,其原因是_____________。
②请补充完整由KClO3制备高纯KClO4固体的实验方案:
向坩埚中加入一定量的KClO3,_____________,在低温下干燥得KClO4固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“在2支大小相同的试管中各装入2~3 mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1 mol/L FeCl3溶液,对比观察现象。”
Ⅰ.体验H2O2分解的实验意义
(1)指出本实验的探究目的:________。
(2)写出H2O2分解反应方程式并标出电子转移的方向和数目:________。
(3)在盛有滴入FeCl3溶液的H2O2溶液中,可观察到溶液中 ________ ;溶液温度升高;溶液由浅黄色变成棕黄色,最后恢复为浅黄色。
Ⅱ.探讨FeCl3催化H2O2分解的机理
(4)Fe3+催化H2O2分解时涉及2步反应:
第1步,Fe3+氧化H2O2:2Fe3++H2O2═2Fe2++O2↑+2H+
第2步,H2O2氧化Fe2+:________(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由KAl(SO4)2、Al2O3和Fe2O3组成的混合物A,在一定条件下可实现下图所示的物质之间的变化[说明:KAl(SO4)2可完全电离生成K+、Al3+、SO42-]:

据此回答下列问题:
(1)根据上述框图反应关系,写出下列B、D所含物质的化学式:固体B______________;沉淀D _________________。
(2)I中分离溶液和沉淀的操作是________________。
(3)写出②的离子方程式_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com