
| A. | 单位体积内活化分子数增多 | B. | 活化分子百分含量增多 | ||
| C. | 单位体积内活化分子数不变 | D. | 活化分子百分含量减少 |
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4+ NO3- CO32- Na+ | B. | Na+ Ba2+ Mg2+ HCO3- | ||
| C. | NO3- Ca2+ K+ Cl- | D. | NO3- K+[Al(OH)4]- H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
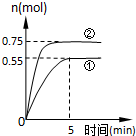 碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:
碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
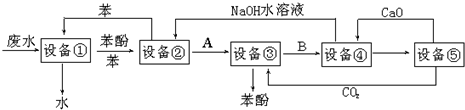
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发、萃取、分液 | B. | 分液、结晶、蒸发 | C. | 过滤、蒸发、萃取 | D. | 萃取、过滤、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 负极发生的反应为:Fe-2e-=Fe 2+ | |
| C. | 正极发生的反应为:2H2O+O2+2e-=4OH- | |
| D. | 钢柱在水下的部分比在空气和水交界出更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com