
| A. | 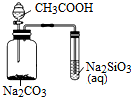 不能用来检验CH3COOH、H2CO3、H2SiO3酸性的强弱 | |
| B. | 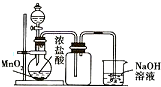 可用来制取并收集氯气 | |
| C. | 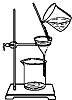 可用来分离氢氧化铁胶体中的胶体粒子 | |
| D. | 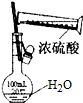 可用来配制一定物质的量浓度的稀硫酸 |
分析 A.醋酸易挥发,醋酸与碳酸钠、硅酸钠均反应;
B.浓盐酸与二氧化锰加热制取氯气;
C.胶体与离子均可透过滤纸;
D.不能将浓硫酸直接注入容量瓶中.
解答 解:A.图中发生强酸制取弱酸的反应,醋酸易挥发,醋酸与碳酸钠、硅酸钠均反应,则不能比较碳酸、硅酸的酸性,故A正确;
B.浓盐酸与二氧化锰加热制取氯气,图中缺少酒精灯加热,且尾气处理装置易发生倒吸,故B错误;
C.胶体与离子均可透过滤纸,不能利用过滤法分离,应选渗析法,故C错误;
D.不能将浓硫酸直接注入容量瓶中,应在烧杯中稀释、冷却后转移到容量瓶中定容,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及酸性比较、气体的制备、混合物分离提纯、溶液配制等,把握物质的性质及反应原理、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
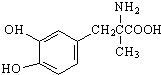
| A. | 1 mol甲基多巴的分子中含有4 mol双键 | |
| B. | 每个甲基多巴分子中含有一个手性碳原子 | |
| C. | 1 mol甲基多巴最多能与2 mol Br2发生取代反应 | |
| D. | 甲基多巴既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | A的一种单质在自然界中硬度最大 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | 同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| D | D的基态原子M层电子数是K层的2 倍 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的最高价氧化物和SiO2都是两性氧化物 | |
| B. | 只含X、Y、Z三种元素的某水溶液一定呈酸性 | |
| C. | 由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同 | |
| D. | M的单质可用于从钛、锆等金属的氯化物中制备钛、锆等单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
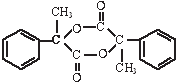 )是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图:
)是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图: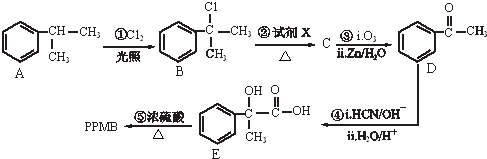
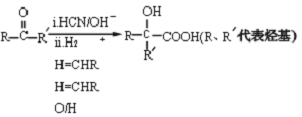
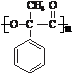 .
. +2NaOH$\stackrel{△}{→}$2
+2NaOH$\stackrel{△}{→}$2 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
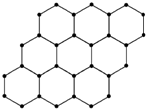
| A. | 石墨烯与石墨互称为同位素 | |
| B. | 12 g石墨烯中约含有6.02×1023个电子 | |
| C. | 石墨烯中可能含有离子键 | |
| D. | 石墨烯中的碳原子间以共价键相结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”).
,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”).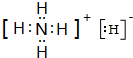 ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
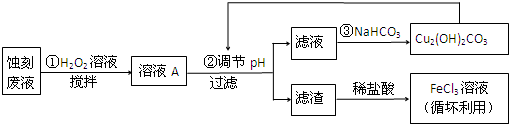
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com