
我国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(1) 仪器A的名称是__________,
水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____________________________
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的______;若滴定终点时溶液的pH=8.8,则选择的指示剂为______;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________( ①=10 mL,②=40 mL,③<10 mL,④>40 mL )
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:
________________________________________________________________________。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,下列关于吸收液的说法正确的是( )
c(Na+) = c(HSO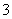 )+ 2c(SO
)+ 2c(SO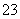 )
)
c(Na+) > c(HSO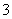 ) = c(SO
) = c(SO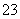 ) > c(H+) = c(OH-)
) > c(H+) = c(OH-)
2c(Na+) = 3c(H2SO3)+3c(HSO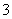 )+3c(SO
)+3c(SO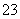 )
)
c(Na+) > c(HSO3- ) + c(SO32- ) +c(H2SO3)
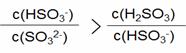
科目:高中化学 来源: 题型:
2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行。能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是 ( )
A.点燃,能燃烧的是矿物油
B.测定沸点,有固定沸点的是矿物油
C.加入水中,浮在水面上的是地沟油
D.加入足量氢氧化钠溶液共热,不分层的是地沟油
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其解释或结论都正确的是( )
A.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
B.向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现红色沉淀,说明X中不含有醛基
C.向CuSO4溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀可能为CuI
D.向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段为使用催化剂;图1中t0~t1阶段c(B)未画出。

(1)若t1=15 min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=_______。
(2)t4~t5阶段改变的条件为________,B的起始物质的量为________。各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
则K1=________(保留两位小数),K1、K2、K3、K4、K5之间的关系为________________(用“>”“<”或“=”连接)。
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,不正确的是( )
A.A、B、C三点所表示的溶液中水的电离程度依次增大
B.加入1 mol NaOH后,溶液中c(Na+)=c(A-)
C.通入HCl, A-的水解程度增大,HA的电离常数减小
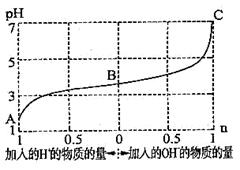 D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA)
D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
在有机合成中,常要将官能团消除或增加,且要求过程科学、简捷,下列相关过程不合理的是( )
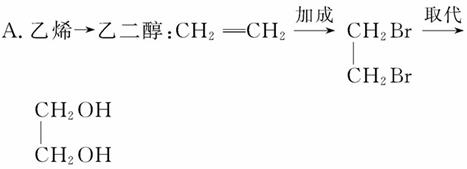
B.溴乙烷→乙醇:CH3CH2Br CH2CH2
CH2CH2  CH3CH2OH
CH3CH2OH
C.乙醛→乙烯:CH3CHO CH3CH2OH
CH3CH2OH CH2=CH2
CH2=CH2
D.乙醇→乙酸:CH3CH2OH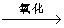 CH3CHO
CH3CHO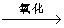 CH3COOH
CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。
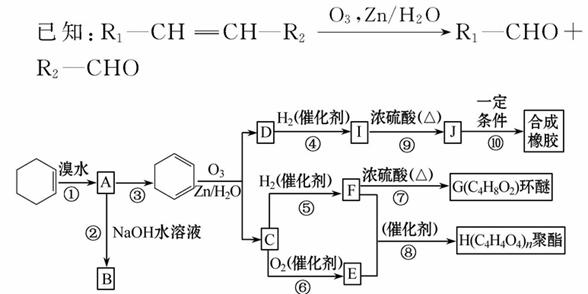
(1)③的反应条件是____________________________________________。
(2)H的名称是_________________________________________________。
(3)有机物B和I的关系为______(填序号)。
A.同系物 B.同分异构体
C.都属于醇类 D.都属于烃
(4)①~⑦中属于取代反应的有: ________________________________。
(5)写出反应⑩的化学方程式:___________________________________。
(6)写出两种D的属于酯类的链状同分异构体的结构简式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对丙酸和甲酸乙酯的说法中,错误的是
A.它们互为同分异构体
B.沸点较高的是甲酸乙酯
C.它们可用红外光谱法鉴别
D.它们可用KMnO4(H+)溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列事实得出的结论正确的是( )
A.Na2SO3试样
 白色沉淀
白色沉淀 沉淀不溶解 结论:此Na2SO3试样已变质
沉淀不溶解 结论:此Na2SO3试样已变质
B.稀硫酸 产生气泡的速率较慢
产生气泡的速率较慢 产生气泡的速率明显加快 结论:CuSO4对此反应有催化作用
产生气泡的速率明显加快 结论:CuSO4对此反应有催化作用
C.某溶液 瓶口产生白雾
瓶口产生白雾 瓶口产生白烟 结论:此溶液一定为浓盐酸
瓶口产生白烟 结论:此溶液一定为浓盐酸
D.无色试液 产生无色无味气体
产生无色无味气体 石灰水变浑浊 结论:原无色试液中可能含有CO
石灰水变浑浊 结论:原无色试液中可能含有CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com