

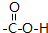 .
.分析 A的分子式为C3H6O2,A在稀硫酸作用下生成B和C,C能连续氧化得E,则C应为醇,则A应为酯,A在稀硫酸条件下能发生水解生成酸和醇,则D为醛,E为酸,
(1)若C与乙酸在浓H2SO4存在的条件下可反应生成C3H6O2的酯,则C为甲醇,所以C为HOCH3,B为CH3COOH,D为HCHO,E为HCOOH,A为CH3COOCH3,据此答题;
(2)若B、C相对分子质量相等,则B为HCOOH,C为CH3CH2OH,D为CH3CHO,E为CH3COOH,A为HCOOCH2CH3,据此答题;
(3)若每摩B和C分别燃烧生成CO2气体的体积比为2:1,则B为CH3COOH,C为HOCH3,D为HCHO,E为HCOOH,A为CH3COOCH3,据此答题.
解答 解:A的分子式为C3H6O2,A在稀硫酸作用下生成B和C,C能连续氧化得E,则C应为醇,则A应为酯,A在稀硫酸条件下能发生水解生成酸和醇,则D为醛,E为酸,
(1)若C与乙酸在浓H2SO4存在的条件下可反应生成C3H6O2的酯,则C为甲醇,所以C为HOCH3,B为CH3COOH,D为HCHO,E为HCOOH,A为CH3COOCH3,A的名称为乙酸甲酯,C的官能团名称为羟基,HCOOH中的官能团为羧基,其的结构式为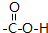 ,
,
故答案为:乙酸甲酯;羟基;HCHO;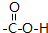 ;
;
(2)若B、C相对分子质量相等,则B为HCOOH,C为CH3CH2OH,D为CH3CHO,E为CH3COOH,A为HCOOCH2CH3,B与C反应生成A的化学方程式为CH3COOH+CH3OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH3+H2O,
故答案为:CH3COOH+CH3OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH3+H2O;
(3)若每摩B和C分别燃烧生成CO2气体的体积比为2:1,则B为CH3COOH,C为HOCH3,D为HCHO,E为HCOOH,A为CH3COOCH3,根据氢元素守恒可知,每摩B和C分别燃烧生成生成水的物质的量之比为1:1,C→D的化学方程式为2CH3OH+O2 $→_{△}^{催化剂}$2HCHO+2H2O,
故答案为:1:1;2CH3OH+O2 $→_{△}^{催化剂}$2HCHO+2H2O.
点评 本题考查有机物推断,涉及酯、醇、醛的性质,掌握官能团的性质与转化是关键,难度不大.


科目:高中化学 来源: 题型:解答题

| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将蒸发皿放置在铁架台的铁圈上直接用酒精灯火焰加热 | |
| B. | 将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| C. | 将蒸发皿放置在三脚架上直接用酒精灯火焰加热 | |
| D. | 将灼热的蒸发皿放置一段时间变凉后,放在冷水中冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种环保型的新涂料,其合成路线如下图所示:
)是一种环保型的新涂料,其合成路线如下图所示:
 ,E是高分子化台物,其结构简式为
,E是高分子化台物,其结构简式为 ;
; $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;
+H2O; (写出其中一种的结构简式).
(写出其中一种的结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com