
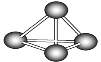
【题目】最近意大利科学家获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知Ⅰ、断裂1 mol N—N吸收167 kJ热量,形成1 mol ![]() 放出942 kJ热量;Ⅱ、N2(g)+3H2(g)
放出942 kJ热量;Ⅱ、N2(g)+3H2(g)![]() 2NH3(g) ΔH1=-92 kJ/mol,N4(g)+6H2(g)
2NH3(g) ΔH1=-92 kJ/mol,N4(g)+6H2(g)![]() 4NH3(g) ΔH2(kJ/mol)根据以上信息和数据,下列说法正确的是( )
4NH3(g) ΔH2(kJ/mol)根据以上信息和数据,下列说法正确的是( )
A.ΔH2>0B.N2分子比N4分子稳定
C.ΔH2=2ΔH1D.ΔH2与方程式系数无关
【答案】B
【解析】
1 mol N4气体中含有6mol N-N键,1 mol N2中含有1 mol N≡N键,1mol N4气体转变为2mol N2的反应热ΔH=化学键断裂吸收的热量-形成化学键放出的热量=6×167kJ/mol -2×942 kJ/mol =1002kJ/mol -1884kJ/mol=-882 kJ/mol,则可得热化学方程式:N4(g)=2 N2(g) ΔH=-882 kJ/mol,再结合已知的热化学方程式和盖斯定律进行分析判断。
在1mol N4气体中含有6mol N-N键,1 mol N2中含有1 mol N≡N键,1mol N4气体转变为2mol N2的反应热ΔH=化学键断裂吸收的热量-形成化学键放出的热量=6×167kJ/mol -2×942 kJ/mol =1002kJ/mol -1884kJ/mol=-882 kJ/mol,则可得热化学方程式:N4(g)=2 N2(g) ΔH=-882 kJ/mol,
A. 已知N4(g)=2 N2(g) ΔH=-882 kJ/mol;N2(g)+3H2(g)![]() 2NH3(g) ΔH1=-92 kJ/mol;
2NH3(g) ΔH1=-92 kJ/mol;
根据盖斯定律可知,热化学方程式N4(g)+6H2(g)![]() 4NH3(g)可由第一个热化学方程式加上第二个热化学方程式的2倍得到,则ΔH2= -882 kJ/mol + 2(-92 kJ/mol)=-1066 kJ/mol, ΔH2<0,A项错误;
4NH3(g)可由第一个热化学方程式加上第二个热化学方程式的2倍得到,则ΔH2= -882 kJ/mol + 2(-92 kJ/mol)=-1066 kJ/mol, ΔH2<0,A项错误;
B. 由分析知,N4(g)=2 N2(g) ΔH=-882 kJ/mol,该反应为放热反应,则反应物1mol N4的总能量大于生成物2mol N2的总能量,而物质的能量越低越稳定,则N2分子比N4分子稳定,B项正确;
C. ΔH1=-92 kJ/mol,ΔH2=-1066 kJ/mol,C项错误;
D. 热化学方程式中化学式前面的化学计量数表示参加反应物质的量,ΔH单位中的“每摩尔”是指每摩尔反应,反应热与化学方程式的系数成正比,D项错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】已知M是短周期金属元素,X和Y是短周期非金属元素,且X、M、Y的原子序数依次增大。三者组成的物质 M3XY(可视为M2X MY)是一种良好的离子导体。研究者在常压下利用下列反应合成M3XY:2M +2MXA + 2MY==2M3XY + A2。其中常温常压下A2是无色无味气体,已知上述反应中消耗0.92 g M的单质可得到标准状况下448 mL的A2。下列有关说法正确的是( )
A.X位于第二周期第IVA族
B.简单离子半径:Y > M > X
C.MXA是共价化合物
D.M3XY溶于水后溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吗替麦考酚酯主要用于预防同种异体的器官排斥反应,其结构简式如下图所示。
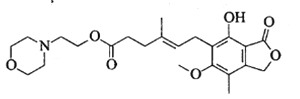
下列说法正确的是
A. 吗替麦考酚酯的分子式为C23H30O7N
B. 吗替麦考酚酯可发生加成、取代、消去反应
C. 吗替麦考酚酯分子中所有碳原子一定处于同一平面
D. 1mol吗替麦考酚酯与NaOH溶液充分反应最多消耗3mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对铝热反应实验展开研究,对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知Al、Al2O3、Fe、Fe2O3的熔、沸点数据如表。
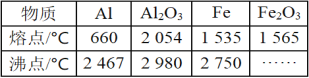
(1)某同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是___。
(2)某同学提出“反应放出大量的热,并发出耀眼的光芒……”,有可能只是发生了铝单质的燃烧放大量热。试利用化学性质设计实验验证铝热反应的发生:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体。在合适反应条件下,它们可以按下面框图进行反应;E溶液是无色溶液,F是淡绿色溶液,B和C反应发出苍白色火焰。请回答:
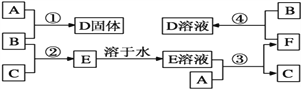
(1)A是_________,B是_________,C是_________![]() 填写化学式
填写化学式![]() ;
;
(2)反应①的化学方程式 ______________________________________;
(3)反应③的离子方程式 _____________________________________;
(4)反应④的离子方程式 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。

现欲用该浓硫酸配制成1mol/L的稀硫酸,现实验室仅需要这种稀硫酸220mL。试回答下列问题:
(1)用量筒量取该浓硫酸____________mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是____。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是__________。
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,仰视容量瓶刻度线
(4)某同学用固体Na2CO3配制500 mlL 0.1molL-1溶液的过程如图所示:
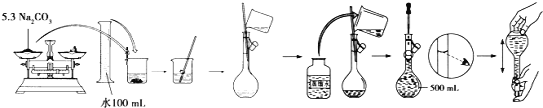
你认为该同学的错误步骤有__________处。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B、C均为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
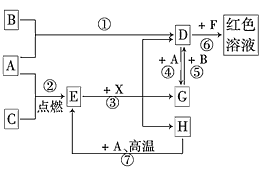
(1)在反应①~⑦中,不属于氧化还原反应的是________(填编号)。
(2)写出③的离子方程式:________________
(3)反应⑦的化学方程式为____;该反应中每消耗0.3 mol的A,可转移电子_________mol。在解决此题时的关键一步是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究。查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐。
该小组同学利用下图装置进行实验(部分夹持仪器略)。

①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)绿色固体中含有的元素是________________________________________________。
(2)加热后试管中剩余的黑色物质是_________________________________________________。
(3)假设该绿色物质是一种纯净物,则其化学式可能是______________,加热分解的化学方程式为_______________________________________________________________________________________。
(4)上述实验步骤③中的反应的离子方程式为________________________________________。
(5)实验装置最后的干燥管的作用是___________________________________________________。
(6)如果将B、C两装置对调,能否达到实验目的______(填“能”或“不能”),为什么?_____________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对牙膏的探究要用到许多化学知识。
(1)下表列出了三种牙膏中的摩擦剂,请在表中填写三种摩擦剂所属的物质类别:____、____、_____。

(2)根据你的推测,牙膏摩擦剂在水中的溶解性是__(填“易溶”或“难溶”)。
(3)Y牙膏中的摩擦剂——碳酸钙可以用石灰石来制备,某学生设计了一种实验室制备碳酸钙的实验方案,其流程如图所示:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请写出上述方案中有关反应的化学方程式:
①__;
②__;
③__。
(4)请你仍用石灰石作原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示的方式,将你的实验方案用流程图表示出来:
![]() →_。
→_。
(5)检验牙膏中是否含有碳酸钙的实验方法是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com