
| A. | 用淀粉溶液检验溶液中是否存在碘离子 | |
| B. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| C. | 用Na2CO3溶液鉴别HCl溶液和H2SO4溶液 | |
| D. | 用焰色反应鉴别NaCl和KNO3 |
科目:高中化学 来源: 题型:填空题
 K增大的有A(填字母)
K增大的有A(填字母)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液c(Na+)与c(CO32-)之比为2:1 | |
| B. | pH=2和pH=1的硝酸中c(H+)之比为1:10 | |
| C. | 0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1 | |
| D. | pH=1的硫酸中加入等体积0.1 mol/L的BaCl2溶液,两者恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的叙述中不正确的是( )
的叙述中不正确的是( )| A. | 常温下,与Na2CO3溶液反应放出CO2 | |
| B. | 能发生水解反应,1 mol 该有机物能与8 mol 的NaOH反应 | |
| C. | 与稀硫酸共热能生成两种有机物 | |
| D. | 该物质的化学式是C14H10O9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2中的硫元素全部被氧化 | |
| B. | 5molFeS2发生反应,有10mol电子转移 | |
| C. | 产物中SO42-有一部分是氧化产物 | |
| D. | FeS2只用作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、SiO32-、Cl-、NO3- | B. | H+、NH4+、Al3+、SO42- | ||
| C. | Na+、S2-、OH-、SO42- | D. | Na+、C6H5O-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
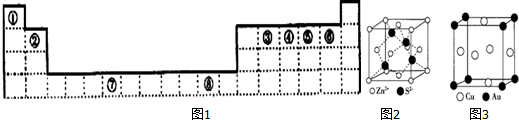
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com