
| A、铝是地壳中含量最多的金属元素 |
| B、硅单质是生产光导纤维的重要原料 |
| C、硅酸盐产品有陶瓷、玻璃、水泥等 |
| D、黄铜比纯铜的硬度大 |


科目:高中化学 来源: 题型:
| A、250mol | B、500mol |
| C、8kg | D、16kg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1的NaCl溶液 |
| B、pH=6的醋酸用水稀释100倍 |
| C、pH=10的氢氧化钠溶液稀释1000倍 |
| D、0.1 mol?L-1的硫酸100 mL跟0.2 mol?L-1 NaOH溶液150 mL完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LCCl4含有C-Cl键的数目为4NA | ||||
| B、取50mL 14.0mol/L浓硝酸与足量铜片反应,生成气体分子的数目为0.35 NA | ||||
C、反应NH4N3
| ||||
| D、电解精炼铜时,若转移的电子数为NA个,则阳极质量减小32g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
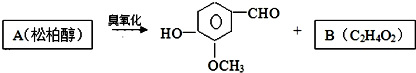
| CH3CHO |
| 碱 |
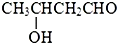
| 一定条件 |

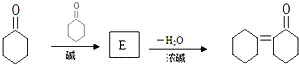 则E的结构简式为
则E的结构简式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com