
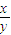 =
=
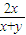 =
=


科目:高中化学 来源:2013-2014学年高考化学三轮复习排查 专题9非金属元素及其化合物练习卷(解析版) 题型:选择题
下列叙述正确的是?? ( )。
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B.浓硫酸与单质硫反应的化学方程式为:S+2H2SO4(浓)  3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
C.把足量铜粉投入到只含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L
D.常温下能够用铁、铝等容器盛放浓H2SO4,是因为浓H2SO4的强氧化性使其钝化
查看答案和解析>>
科目:高中化学 来源:同步题 题型:单选题
 3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com