
【题目】利用锌锰干电池内的黑色固体水浸后的碳包滤渣(含MnO2、C、Hg2+等)制取MnSO4 H2O 的实验流程如下:

已知:25℃时,几种硫化物的溶度积常数如下:
物质 | FeS | MnS | HgS |
溶度积 | 5.0×l0-18 | 4.6×l0-14 | 2.2×l0-54 |
25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
开始沉淀的pH | 2.7 | 7.6 | 8.3 |
完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(1)上述流程中,蒸发实验操作时用到的硅酸盐材质的仪器有______________。
(2)在加热条件下“浸取”,其原因是__________________;浸取时生成MnSO4和Fe2(SO4)3的化学方程式为__________________________。
(3)滤渣I的成分为MnO2、C和____________(填化学式);若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中的c(Hg2+)/C(Fe2+)= ____________(填数值)。
(4)“氧化”时的离子方程式为____________;氧化时可用H2O2代替MnO2,H2O2的电子式为_______。
(5)中和时,应该调节溶液pH的范围到____________。
【答案】 蒸发皿、玻璃棒、酒精灯 加快浸取时的反应速率 9MnO2+2FeS+10H2SO4=9MnSO4+Fe2(SO4)3+10H2O HgS 4.4×10-37 2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O ![]() 3.7 ≤ pH <8.3
3.7 ≤ pH <8.3
【解析】碳包滤渣在浸取时,FeS将其中的二氧化锰还原为可溶性的MnSO4,还可以将汞离子转化为溶度积更小的HgS过滤后除去。氧化时,将溶液中剩余的亚铁离子氧化为Fe3+。中和时,用碳酸锰调pH为3.7~8.3,使Fe3+水解为Fe(OH)3后过滤除去且不会生成Mn(OH)2沉淀,滤液中含硫酸和硫酸锰两种溶质,经蒸发浓缩、降温结晶、过滤、洗涤、干燥后得到了产品硫酸锰晶体。
(1). 上述流程中,蒸发实验操作时用到的硅酸盐材质的仪器有蒸发皿、玻璃棒、酒精灯。
(2). 在加热条件下“浸取”,可以加快浸取时所发生的化学反应速率;浸取时生成MnSO4和Fe2(SO4)3的化学方程式为9MnO2+2FeS+10H2SO4=9MnSO4+Fe2(SO4)3+10H2O。
(3). 滤渣I的成分除MnO2、C之外,还有HgS;若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中的c(Hg2+)/c(Fe2+)= ![]() =
=![]() = 4.4×10-37。
= 4.4×10-37。
(4). “氧化”时的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;氧化时可用H2O2代替MnO2,H2O2的电子式为![]() 。
。
(5). 中和时,应该调节溶液pH的范围到3.7 ≤ pH <8.3 。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验现象的叙述,不正确的是( )
A.氢气在氯气中燃烧,发出苍白色火焰
B.铁丝在氯气中燃烧,生成红棕色烟
C.钠在氯气中燃烧,生成白色的烟
D.铜丝在氯气中燃烧,生成蓝色的烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度、相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别为 ( )
![]()
A.NH4Cl (NH4)2SO4 CH3COONa
B.(NH4)2SO4 NH4Cl CH3COONa
C.(NH4)2SO4 NH4Cl NaOH
D.CH3COOH NH4Cl (NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某碱性溶液中,由水电离出来的c(OH-)=10-4 mol/L,则该溶液中的溶质可能是
A. Al2(SO4)3 B. KHSO4 C. NaOH D. CH3COONa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了如下图所示的实验装置。
|
|
|
|
A | B | C | D |
(1)为验证上述气体,将混合气体依次通过所用仪器,其顺序为:混合气体→_____→ A →_____→_____(每种仪器只能使用一次)
(2)A中品红溶液的作用是__________________________。
(3)确定有CO2生成的实验现象是____________________________________________。
(4)在不影响实验检验结果的情况下,理论上B中的高锰酸钾溶液还可以用下列哪些试剂代替_____________
①饱和NaHCO3溶液 ②浓硫酸 ③氯水 ④H2S溶液 ⑤Na2SO3溶液
Ⅱ.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:
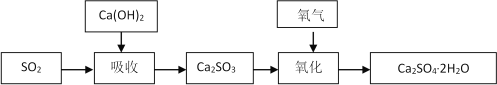
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
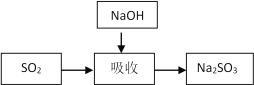
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
(1)石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 ____________________ 。和碱法相比,石灰-石膏法的优点是 ________________ ,缺点是 ________________ 。
(2)某学习小组在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是__________________、___________________、___________________(填化学式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明CH4的空间构型是正四面体而不是平面正方形的是
A. 4个H与C的距离相等 B. CH4没有同分异构体
C. CH4分子中的键角相等 D. CH2Cl2没有同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制备氯气并进行一系列相关的实验(加热装置和夹持设备已省略).
![]()
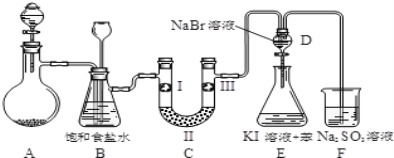
(1)A中盛装液体仪器的名称是:______.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是______;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:____________.
(3)制备氯气选用的药品为:MnO2和浓盐酸,写出制备氯气的化学反应方程式___________________.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入(填符号)______.
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯___溴(填“>”或“<”).
(6)反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_________________,根据上述现象(“能”、“不能”)___说明非金属性溴强于碘。
(7)F处为尾气吸收装置,写出其离子反应方程式__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T、R 为两种常见的用途广泛的金属单质,D具有磁性的黑色晶体,C是无色无味的气体,M为红褐色固体。回答相关问题
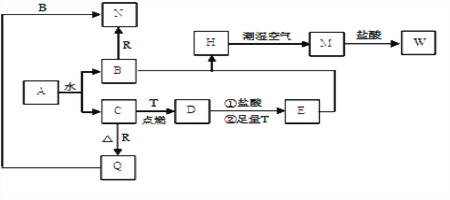
(1)写出D的化学式: ____________
(2)写出A的电子式: _____________
(3)H在潮湿空气中变为M的现象是:______________化学方程式为: ________________
(4)B与R反应的化学方程式为: __________________________
(5)向沸水中加入W饱和溶液,可制得一种红褐色透明液体,区别该液体和溶液W的简单实验方法是 ____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com