
【题目】实现下列变化需要加入还原剂才能实现的是
A.Fe2O3→Fe
B.NH3→NH4Cl
C.SO3→H2SO4
D.H2SO4→SO3
科目:高中化学 来源: 题型:
【题目】如图所示三套实验装置,分别回答下列问题。
图1
图2
图3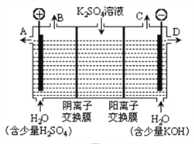
(1)图1中,① 若开始时开关K与a连接,则该装置为_____(填装置名称),电极A的电极反应式为________________________
②若开始时开关K与b连接,则总反应的离子方程式为___________________
(2)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图2所示:
①______极(填a或b)为电池的正极,电池工作时电子的流向为_________(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(3)用图3装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阴极反应式为_____________________。
②制得的硫酸溶液从出口__________________________(填“A”、“D”)导出,并简述原因__________________________(请用化学用语和文字解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.稀硫酸溶液中不存在H2SO4分子
B.凡是能电离的物质一定能达到电离平衡
C.氯化钠溶液在电流作用下电离成钠离子和氯离子
D.氨水中全部是NH4+、OH-,无分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
A. AgCl不溶于水,不能转化为AgI
B. 在含有浓度均为0.001mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C. AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D. 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]() ×10-11mol·L-1
×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常电动汽车使用的是锂电池,制备锂电池正极材料的主要原料为四氧化三钴,工业上用CoCl2·6H2O制备四氧化三钴。以水钴矿(主要成分为Co2O3、CoO、CuO、Fe2O3和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
(1)“酸浸”
①写出滤渣A主要成分的一种用途________。钴的浸出率随酸浸时间、温度的变化关系如图所示。综合考虑,应选择的最佳工艺条件为________。

②Co2O3与浓硫酸反应除生成CoSO4和H2O外,还生成的一种物质是________。
(2)“净化除杂”过程包括除铁、除铜等步骤。
①除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,写出反应的离子方程式____________________________________。
②除铜:加入适量Na2S2O3,发生反应2Cu2++2S2O32-+2H2O=Cu2S↓+S↓+4H++2SO42-,其中氧化产物为___________。
(3)“萃取和反萃取”
①试剂X的名称为_____________。
②实验室称取100 g原料(含钴11.80%),反萃取时得到浓度为0.036 mol·L-1的CoCl2溶液5 L,忽略损耗,钴的产率=_____________。
(4)以CoCl2·6H2O与NH4HCO3为原料,经两步经典反应合成四氧化三钴,第一步在80℃条件下二者生成Co2(OH)2CO3;第二步在600~820℃下Co2(OH)2CO3在空气中转化生成四氧化三钴,写出第二步反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料之一的天然气,其主要成分是甲烷.请回答下列问题.
(1)甲烷的电子式是:______________________.
(2)甲烷与氯气在光照下反应的产物有_______________种,该反应的类型是________.
(3)甲烷的空间构型是________________,可证明其构型的实验事实是:___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A.CaCO3 ![]() CaO+CO2↑B.SO3 + H2O=H2SO4
CaO+CO2↑B.SO3 + H2O=H2SO4
C.AgNO3+NaCl=AgCl↓+NaNO3D.Fe+CuSO4=FeSO4+Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_______________________________.
(2)已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol;
②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H3=-285.8kJ/mol,
则2C(s)+2H2(g)+O2(g)= CH3COOH(l)的反应热是______________
(3)如图是N2和H2反应生成2mol NH3过程中能量变化示意图,
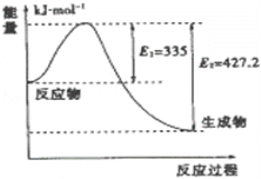
①请计算每生成1mol NH3放出热量为:________,逆反应所需的活化能为__________________ kJ/mol。
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为__________________;
(4)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
①如用醋酸代替盐酸进行实验,所测中和热的数值将________(填“偏大”“偏小”或“无影响”,下同);
②如用70mL0.50mol/L盐酸进行实验,所测中和热数值将__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com