
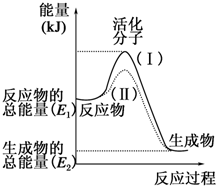
 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图,然后回答问题.分析 (1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热,故答案为:放热;
(2)在反应H2+I2?2HI中,断裂1molH-H键,1molI-I键共吸收的能量为:1×436kJ+151kJ=587kJ,生成2molHI,共形成2molH-I键,放出的能量为:2×299kJ=598kJ,吸收的能量少,放出的能量多,所以该反应为放热反应,放出的热量为:598kJ-587kJ=11kJ,故答案为:放出;11;
(3)①物质燃烧属于放热反应; ②炸药爆炸属于放热反应; ③酸碱中和反应属于放热反应; ④二氧化碳通过炽热的碳虽然属于化合反应,但为吸热反应;
⑤食物因氧化而腐败属于放热反应; ⑥Ba(OH)2•8H2O与NH4Cl反应为吸热反应 ⑦铁粉与稀盐酸反应属于放热反应;
所以放热反应有:①②③⑤⑦;吸热反应有:④⑥,
故答案为:①②③⑤⑦;④⑥.
点评 本题考查焓变的求算,△H=生成物能量-反应物能量=反应物键能和-生成物键能和,以及化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H )═10-13mol/L 溶液:Mg2+、Cu2+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、NH4+、Cl-、S2- | |
| C. | 高锰酸钾溶液:Fe3+、H+、SO42-、C2H5OH | |
| D. | 中性溶液中:Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36g镁在足量的氮气中完全燃烧共转移的电子数为3NA | |
| B. | 1mol铁与足量的盐酸反应转移电子数为2 NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与苛性钠反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 在NaCl溶液中滴入AgNO3试液:Ag++Cl-═AgCl↓ | |
| C. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用NaOH溶液吸收Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
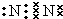 ,在这些元素中,化学性质最不活泼的是:Ar
,在这些元素中,化学性质最不活泼的是:Ar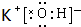 .
.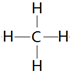 .
. ,该化合物属于离子 (填“共价”或“离子”)化合物.
,该化合物属于离子 (填“共价”或“离子”)化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com