
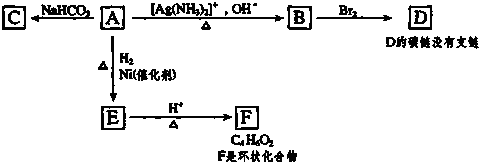
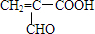 ;
;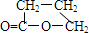 ,由E生成F的反应类型是酯化反应.
,由E生成F的反应类型是酯化反应. 分析 首先利用化学性质确定A分子所含官能团:能与NaHCO3反应必含-COOH,能与银氨溶液反应必含-CHO.而A与H2(Ni、△)生成E可能是-CHO与H2加成,也可能是A分子中含碳碳不饱和键.联系B与Br2反应生成没有支链的化合物D,说明A中应含碳碳不饱和键(银镜反应不影响C=C、C≡C);再根据题中设问(2)1molA与2molH2加成,可确定A中含C=C.由F可知A的分子中应含4个碳原子,具有以上官能团的结构可能是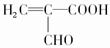 (Ⅰ)或HOOC-CH=CH-CHO (Ⅱ),Ⅰ式发生银镜反应后碳链有支链,Ⅱ式则符合碳链无支链的条件,则A应为HOOC-CH=CH-CHO,则B为HOOC-CH=CH-COOH,D为HOOCCHBrCHBrCOOH,E为CH2(OH)CH2CH2COOH,分子中含有-OH和-COOH,自身发生酯化反应可形成环酯F,F为
(Ⅰ)或HOOC-CH=CH-CHO (Ⅱ),Ⅰ式发生银镜反应后碳链有支链,Ⅱ式则符合碳链无支链的条件,则A应为HOOC-CH=CH-CHO,则B为HOOC-CH=CH-COOH,D为HOOCCHBrCHBrCOOH,E为CH2(OH)CH2CH2COOH,分子中含有-OH和-COOH,自身发生酯化反应可形成环酯F,F为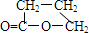 ,结合有机物的结构和性质解答该题.
,结合有机物的结构和性质解答该题.
解答 解:根据题给信息可知A为HOOC-CH=CH-CHO,则B为HOOC-CH=CH-COOH,D为HOOCCHBrCHBrCOOH,E为CH2(OH)CH2CH2COOH,F为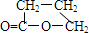 ,则
,则
(1)A能和银氨溶液反应,说明A中有醛基,又能和碳酸氢钠反应,故A中一定有羧基,还能和氢气在镍作催化剂作用下加成为G,G分子内酯化生成了分子式为C4H6O2的环状物H,故A中有双键,
故答案为:碳碳双键、醛基、羧基;
(2)1molA中的双键和醛基均可以被氢气加成,共消耗2molH2,
反应方程式为HOOC-CH=CH-CHO+2H2$→_{△}^{催化剂}$CH2(OH)CH2CH2COOH,
故答案为:HOOC-CH=CH-CHO+2H2$→_{△}^{催化剂}$CH2(OH)CH2CH2COOH;
(3)A为HOOC-CH=CH-CHO,与A具有相同官能团的A的同分异构体的结构简式是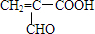 ,
,
故答案为: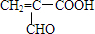 ;
;
(4)B为HOOC-CH=CH-COOH,与溴发生加成反应生成D,D为HOOCCHBrCHBrCOOH,
故答案为:HOOCCHBrCHBrCOOH;
(5)E为CH2(OH)CH2CH2COOH,分子中含有-OH和-COOH,自身发生酯化反应可形成环酯F,F为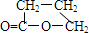 ,故答案为:
,故答案为: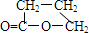 ;酯化反应.
;酯化反应.
点评 本题考查有机物的推断,为高考常见题型,题设情景相对比较简单,难度不大,但考查的内容比较全面,涵盖了有机化学的基础知识,考查考生的书写基本功.可根据A能与盐、银氨溶液、溴(或氢气)反应来确定官能团,注意根据转化关系、反应条件、F的碳数、D的特征来确定A的结构简式,从而确定其余各物质的结构简式,顺利完成题中各项要求.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2的立体结构模型 | B. | PH3的立体结构模型  | ||
| C. | H2S的立体结构模型 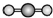 | D. | CH4的立体结构模型 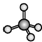 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na在空气中缓慢氧化生成白色的Na2O2 | |
| B. | Na在空气中燃烧生成淡黄色的Na2O2 | |
| C. | Na在空气中燃烧生成淡黄色的Na2O | |
| D. | Na在空气中燃烧生成白色的Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 HCl | B. | Ba(NO3)2 HNO3 | C. | Ba(NO3)2 HCl | D. | BaCl2 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则该有机物核磁共振氢谱有3 个峰.
,则该有机物核磁共振氢谱有3 个峰.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 gO2中含有的氧分子数为NA | |
| B. | 1 mol镁原子中含有的电子数为NA | |
| C. | 常温常压下,11.2 L H2中含有的氢分子数为0.5NA | |
| D. | 1L 1 mol/L BaCl2溶液中含有的钡离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、OH- | B. | H+、Cl-、CH3COO- | C. | Fe2+、H+、NO3- | D. | K+、Ca2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
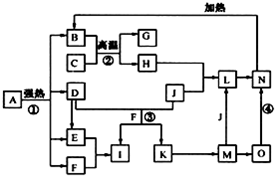 仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去).请按要求回答:
仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去).请按要求回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com