
| A. | 11.2L<a<22.4L | |
| B. | 若a=16.8L,V(N2O4)=5.6L | |
| C. | 若a=16.8L,n(NaNO2):n(NaNO3)=4:1 | |
| D. | 若混合气体与NaOH溶液反应只生成一种盐,则n(NO)=0.5mol |
分析 A.根据原子守恒可知,当气体完全为N2O4时,气体体积最小,当完全为二氧化氮时,气体体积最大;
B.根据反应可知,NO、NO2与氢氧化钠溶液完全反应时,无论二氧化氮是否过量,气体的物质的量与氢氧化钠的物质的量相等,所以消耗的气体减少的部分恰好为四氧化二氮的物质的量,据此列式计算;
C.根据B可知,V(N2O4)=5.6L,剩余的气体为NO、NO2的混合物,由于二氧化氮只要过量就可以完全被吸收,则无法计算生成的硝酸钠和亚硝酸钠的物质的量之比;
D.若混合气体与NaOH溶液反应只生成一种盐,则该盐只能为亚硝酸钠,根据反应方程式NO2+NO+2NaOH=2NaNO2+H2O及氢氧化钠的物质的量计算出NO的物质的量.
解答 解:A.1L 1mol/L的NaOH溶液中含有氢氧化钠的物质的量为:1mol/L×1L=1mol,根据原子守恒可知,当气体完全为N2O4时,转化成二氧化氮时体积为2a,
根据反应2NO2+2NaOH=NaNO2+NaNO3+H2O可知,$\frac{2amol}{22.4L/mol}$=1mol,解得:a=11.2,;当完全为二氧化氮或(NO、NO2的体积1:1)时,气体体积最大,则:$\frac{amol}{22.4L/mol}$=1mol,解得:a=22.4,所以a的范围为:11.2L<a<22.4L,故A正确;
B.根据反应方程式可知,NO、NO2与氢氧化钠溶液完全反应时,无论二氧化氮是否过量,气体的物质的量与氢氧化钠的物质的量相等,则消耗的气体减少的部分恰好为四氧化二氮的物质的量,氢氧化钠为1mol,完全反应消耗标况下气体体积为:22.4L/mol×1mol=22.4L,故混合气体中二氧化氮的体积为:22.4L-16.8L=5.6L,故B正确;
C.若a=16.8L,根据B可知四氧化二氮的体积为5.6L,结合反应可知,只要V(NO2)≥V(NO),氢氧化钠溶液就可以完全吸收气体,由于无法判断一氧化氮和二氧化氮的物质的量,则无法计算生成硝酸钠和亚硝酸钠的物质的量之比,故C错误;
D.若混合气体与NaOH溶液反应只生成一种盐,则该盐只能为NaNO2,根据反应方程式NO2+NO+2NaOH=2NaNO2+H2O可知,NO的物质的量为:n(NO)=$\frac{1}{2}$n(NaOH)=0.5mol,故D正确;
故选C.
点评 本题考查混合物计算、根据方程式计算,题目难度中等,侧重于学生的分析能力和计算能力的考查,判断气体完全吸收满足的条件是关键,属于字母型计算,增大计算难度,为易错题目.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )| A. | 0.5•(a+b-c-d)kJ/mol | B. | 0.5•(c+a-d-b)kJ/mol | ||
| C. | 0.5•(c+d-a-b)kJ/mol | D. | 0.5•(c+d-a-b)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
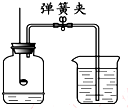 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中,不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中,不正确的是( )| A. | 实验时红磷一定过量 | |
| B. | 点燃红磷前先用弹簧夹夹紧乳胶管 | |
| C. | 红磷熄灭后立刻打开弹簧夹 | |
| D. | 最终进入瓶中水的体积约为氧气的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(稀)$→_{△}^{Cu}$SO2$\stackrel{少量氨水}{→}$NH4HSO3$\stackrel{足量氨水}{→}$(NH4)2SO3 | |
| B. | NH3$→_{催化剂△}^{O_{2}}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 | |
| D. | Al$\stackrel{NaOH溶液}{→}$NaAlO2$\stackrel{足量盐酸}{→}$AlCl3溶液$\stackrel{△}{→}$无水AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH2.H2O | |
| B. | 高锰酸钾酸性溶液吸收二氧化硫:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ | |
| C. | Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| D. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 生石灰 | AlCl3溶液 | Al(OH)3具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 醋酸 | Na2CO3 | Na2SiO3 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
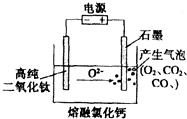 如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )
如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )| A. | 阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 通电后,O2-、Cl-均向阴极移动 | |
| C. | 阴极的电极反应式为TiO2+4e-=Ti+2O2- | |
| D. | 石墨电极的质量不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的无色溶液中:K+、NH4+、SO42-、MnO4- | |
| B. | 水电离出的c(OH-)=10-12 mo1•L-1的溶液中:Fe2+、Ba2+、NO3-、ClO- | |
| C. | 含大量A13+的溶液中:Na+、SO42-、NO3-、[Al(OH)4]- | |
| D. | CO2的饱和溶液中:K+、Ca2+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com