
| A. | 醛基的电子式: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 尿素[CO(NH2)2]是一种有机物 | D. | 聚丙烯的化学式: |
分析 A.氧原子最外层达到8个电子,氧原子的孤对电子没有写出;
B.乙烯的结构简式中漏掉了碳碳双键;
C.尿素分子中含有C、H、O、N等元素,属于有机物;
D.聚丙烯的结构单元中中主链含有2个碳原子.
解答 解:A.醛基中含有1个碳氢键和1个碳氧双键,醛基正确的电子式应为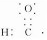 ,故A错误;
,故A错误;
B.乙烯分子中含有碳碳双键,结构简式中需要标出官能团结构,乙烯正确的结构简式为:CH2=CH2,故B错误;
C.尿素[CO(NH2)2]中含有C、H、O、N元素,含有官能团氨基和羰基,属于有机物,故C正确;
D.聚丙烯为丙烯通过加聚反应生成的高分子化合物,其结构单元的主链含有2个C,聚丙烯正确的结构简式为: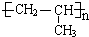 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,涉及电子式、结构简式等知识,注意掌握常见化学用语的概念及书写原则,明确有机物与无机物的区别,试题培养了学生的灵活应用能力.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:解答题
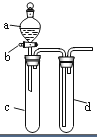 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 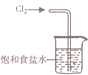 用装置吸收多余的氯气 | B. |  装置用酒精萃取分离水中的碘 | ||
| C. |  用装置除去纯碱中的小苏打 | D. |  用装置排水法收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>A | |
| B. | 气态氢化物的稳定性:A>B | |
| C. | 最髙价氧化物对应水化物的碱性:C<D | |
| D. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷在浓硫酸加热条件下可制得乙烯 | |
| B. | 一定条件下,所有的醇均能发生脱水反应形式碳碳双键或碳碳叁键 | |
| C. | 石油的裂化、裂解,煤的气化、液化都是化学变化 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 3,3-二乙基戊烷;
3,3-二乙基戊烷; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是良好的半导体材料 | |
| B. | 氨气与硝酸合成氮肥属于人工固氮 | |
| C. | 金刚石、石墨和富勒烯互为同素异形体 | |
| D. | 硬铝、青铜和不锈钢都属于合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
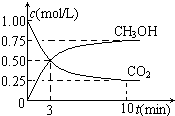 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com