
| A. | 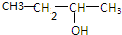 | B. |  | C. | 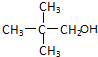 | D. | 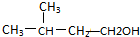 |
分析 根据醇发生消去反应的结构特点是:与羟基所连碳相邻的碳上有氢原子才能发生消去反应,形成不饱和键;醇发生氧化反应的结构特点是:有羟基所连碳上有氢原子的才能发生氧化反应,若生成醛,则羟基所连的C上含有2个H原子.
解答 解:A、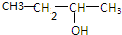 可以发生消去反应生成丁烯,发生氧化反应生成丁酮,故A错误;
可以发生消去反应生成丁烯,发生氧化反应生成丁酮,故A错误;
B、 可以发生消去反应生成戊烯,但由于与羟基所连C上午H原子,故不能发生氧化反应,故B错误;
可以发生消去反应生成戊烯,但由于与羟基所连C上午H原子,故不能发生氧化反应,故B错误;
C、 不能发生消去反应,故C错误;
不能发生消去反应,故C错误;
D、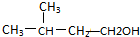 能发生消去反应生成戊烯,能发生氧化反应生成戊醛,故D正确,
能发生消去反应生成戊烯,能发生氧化反应生成戊醛,故D正确,
故选D.
点评 本题考查醇的消去反应、氧化反应,难度不大,注意羟基发生消去反应的结构特点是:与-OH相连碳相邻碳上有氢原子的才能发生消去反应.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯与水反应生成乙醇,乙炔与氢气反应 | |
| B. | 光照下,丙烷与氯气的反应;丙炔与溴的四氯化碳溶液反应 | |
| C. | 丙烯与酸性高锰酸钾溶液反应;丁烷燃烧 | |
| D. | 乙烯生成聚乙烯,乙炔生成聚乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
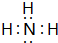 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某单质在常温下跟水反应不如钠剧烈 | |
| B. | 某碳酸盐易溶于水 | |
| C. | 其原子半径比钾原子半径小 | |
| D. | 某氢氧化物不能使Al(OH)3溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的平衡常数表达式:K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$ | |
| B. | 若容器内气体的压强保持不变,说明该反应已达到平衡状态 | |
| C. | 若Fe3O4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 | |
| D. | 经2min后,H2浓度下降了0.1mol.L-1则反应速度为v(H2O)=0.05mol.L-1.min-1. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
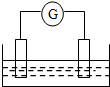 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com