
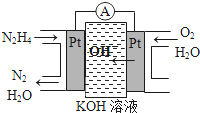
 某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:分析 短周期元素的原子最外层电子数为次外层的2倍,则该元素为C元素.
(1)①若丙为NO2,则乙为浓硝酸、丁为二氧化碳;
②已知:Ⅰ.N2(g)+2O2(g)═2NO2(g)△H=-67.7kJ•mol-1
Ⅱ.N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
Ⅲ.2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
根据盖斯定律,Ⅱ×2-Ⅲ-Ⅰ可得:2 N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);
③左边Pt电极上,肼氧化生成氮气,则左边Pt电极为负极,右边Pt电极为正极;
(2)若丙为SO2,则乙为浓硫酸.
①浓硫酸具有吸水性;
②SO2气体用足量的NaOH溶液吸收生成Na2SO3,亚硫酸钠水解,溶液显碱性;
③A.元素化合价升高,发生氧化反应;
B.溶液体积未知,不能计算生成氢离子浓度;
C.SO2使品红溶液褪色,不是氧化还原反应;
D.氯气具有氧化性,SO2具有还原性,二者发生氧化还原反应,生成硫酸和盐酸.
解答 解:短周期元素的原子最外层电子数为次外层的2倍,则该元素为C元素.
(1)①丙是NO2,则乙是浓硝酸,和碳反应氧化还原反应,反应方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
②已知:Ⅰ.N2(g)+2O2(g)═2NO2(g)△H=-67.7kJ•mol-1
Ⅱ.N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
Ⅲ.2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
根据盖斯定律,Ⅱ×2-Ⅲ-Ⅰ可得:2 N2H4(g)+N2O4(g)═3N2(g)+4H2O(g),所以△H=-534.0 kJ/mol×2+67.7 kJ/mol+52.7 kJ/mol=-947.6kJ/mol,
故答案为:2 N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-947.6kJ•mol-1;
③左边Pt电极上,肼氧化生成氮气,右侧通入氧气,则左边Pt电极为负极,右边Pt电极为正极,肼失去电子发生氧化反应,电极反应式为:N2H4-4e-+4OH-═N2+4H2O,
故答案为:正极; N2H4-4e-+4OH-═N2+4H2O;
(2)若丙为SO2,则乙是浓硫酸,丁是CO2.
①浓硫酸具有吸水性,可以吸收胆矾中的水分子,生成无水硫酸铜,所以蓝色晶体变白色粉末,
故答案为:蓝色晶体变为白色粉末;
②SO2和氢氧化钠反应生成亚硫酸钠,亚硫酸钠水解,溶液显碱性,所以浓度大小顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
③A.二氧化硫失去电子发生氧化反应,故A正确;
B.每转移2mol电子,就生成4mol氢离子,所以若转移电子物质的量为0.05mol,则生成氢离子的物质的量为0.1mol,但溶液的体积是未知的,所以无法计算pH,故B错误;
C.Fe2(SO4)3具有氧化性能氧化二氧化硫使反应进行,品红会结合二氧化硫形成不稳定的无色物质不能使氧化反应进行,故C错误;
D.氯气和二氧化硫反应,SO2+Cl2+2H2O=H2SO4+2HCl,所以通入Cl2会降低SO2的漂白作用,故D正确;
故选:BC.
点评 本题考查元素化合物性质、热化学方程式、原电池、盐类水解、氧化还原反应等,属于拼合型题目,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸、碱、盐、氧化物在组成上的共同点是都含有非金属元素 | |
| B. | 只含有一种元素的物质都是纯净物 | |
| C. | 制糖工业中利用活性炭脱色制白糖的过程是物理变化 | |
| D. | 压强恒定时,气体在水中的溶解度随温度的升高而降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、NH3、SO3 | B. | CO2、CH4、C2H5OH | C. | NO、CaO、Ne | D. | P4、CS2、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
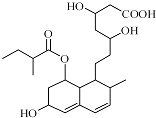
| A. | 该分子中有三种官能团 | B. | 能与FeCl3溶液发生显色反应 | ||
| C. | 能发生加成、取代、消去反应 | D. | 1mol该物质最多可与1molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1 mol任何物质的体积约为22.4 L | |
| B. | 1 mol气体的体积约为22.4 L | |
| C. | 1 mol氖气和1 mol氧气体积相同 | |
| D. | 在标准状况下,1 mol氖气和氯气混合气体(任意体积比)的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 950mL、20.14g | B. | 950mL、10.07g | C. | 1000mL、21.20g | D. | 1000mL、10.60g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com