
| 酸 | H2CO3 | CH3COOH | HClO |
| K | K1=4.4×10-7;K 2=4.7×10-11 | K=1.76×10-5 | K=2.95×10-8 |
分析 (1)碳酸钠溶液中碳酸根离子分步水解溶液显碱性;
(2)电离平衡常数越大酸性越强,酸性越弱对应盐水解程度越大;
(3)100mL 0.02mol•L-1的Ba(OH)2溶液中氢氧根离子浓度物质的量为:0.02mol•L-1×0.1L×2=0.004mol;100mL 0.02mol•L-1的NaHSO4溶液中氢离子的物质的量为:0.02mol•L-1×0.1L=0.002mol,两溶液混合后氢氧根离子过量,溶液显示碱性,根据氢氧根离子、氢离子的物质的量计算出混合后溶液中氢氧根离子的浓度,再计算出溶液的pH;
(4)根据氢氧化镁与氟化镁的化学式相似,由题中数据可知氢氧化镁的溶度积小,其饱和溶液中Mg2+浓度较小;氢氧化镁存在着微弱的电离,产生的氢氧根和氯化铵电离出来的铵根结合,产生一水合氨,使平衡正向移动,所以镁离子的浓度增加.
解答 解:(1)碳酸钠溶液中碳酸根离子分步水解溶液显碱性,离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(2)电离平衡常数越大酸性越强,图表中可知:电离平衡常数CH3COOH>H2CO3>HClO>HCO3-,酸性越弱对应盐水解程度越大,对应盐的水解程度Na2CO3>NaClO>NaAc,
故答案为:CH3COOH>H2CO3>HClO;NaAc<NaClO<Na2CO3;
(3)100mL 0.02mol•L-1的Ba(OH)2溶液中氢氧化钡物质的量为:0.02mol•L-1×0.1L=0.002mol,氢氧根的物质的量为0.004mol;
100mL 0.02mol•L-1的NaHSO4溶液中硫酸氢钠的物质的量为:0.02mol•L-1×0.1L=0.002mol,氢离子的物质的量为:0.002mol;
A.两溶液混合后,氢氧根离子过量,溶液显示碱性,反应后的溶液中氢氧根离子浓度为:$\frac{0.004mol-0.002mol}{0.1L+0.1L}$=0.01mol/L,溶液的pH=12
故答案为:12;
(4)因氢氧化镁溶度积小,由Ksp计算则其Mg2+浓度小,该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,MgF2溶液中的 c(Mg2+)大,
故答案为:MgF2.
点评 本题考查了弱电解质电离平衡影响、盐类水解应用、酸碱混合后的定性判断及溶液的pH的计算、溶度积常数计算,题目难度中等,注意掌握酸碱反应后溶液定性判断方法及溶液的pH的计算方法,掌握基础是解题关键.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁片投入足量浓H2SO4中,转移电子数目为0.3 NA | |
| B. | MnO2与浓盐酸共热,0.4 molHCl被氧化时,转移电子数目为0.4 NA | |
| C. | 高温下,0.3 molFe与足量水蒸气反应,转移电子数目为0.8NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3m+n)mol | B. | ($\frac{5}{2}$ m+$\frac{n}{2-3P}$)mol | C. | (3m+n+2p)mol | D. | ($\frac{5m}{2}$+$\frac{n}{2}$)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28.58kJ | B. | 24.18kJ | C. | 57.16kJ | D. | 48.36kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
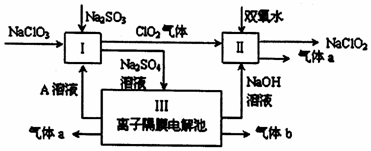
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
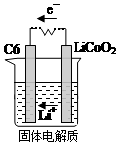 某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )
某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )| A. | 阴极 | B. | 阳极 | C. | 负极 | D. | 正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用浓硫酸干燥氯气、氯化氢等气体 | |
| B. | 将KI与浓硫酸混合,有紫色蒸气产生 | |
| C. | 浓硫酸与氧化铁反应,生成硫酸铁 | |
| D. | 用浓硫酸在木制品上“烙”字画 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com