
| A. | 常温常压下测得1mol N2的质量为28 g | |
| B. | 用100mL量筒测得排水法收集制得的氢气体积为50.28mL | |
| C. | 用两个250mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 | |
| D. | 用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90g |
分析 A.根据m=nM计算氮气质量;
B.量筒的感量是0.1mL;
C.配制一定物质的量浓度溶液时,选取容量瓶规格应该等于或稍微大于配制溶液体积;
D.托盘天平感量是0.1g.
解答 解:A.氮气质量=1mol×28g/mol=28g,故A正确;
B.量筒的感量是0.1mL,所以用100mL量筒测得排水法收集得到氢气体积不能为50.28mL,故B错误;
C.配制一定物质的量浓度溶液时,选取容量瓶规格应该等于或稍微大于配制溶液体积,所以配制500mL溶液应该选取500mL容量瓶,故C错误;
D.托盘天平感量是0.1g,所以用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.9g而不是0.90g,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器的选取和运用、物质的量的计算,侧重考查学生分析判断及计算能力,注意含有量筒、滴定管、托盘天平感量,注意A中n、M、m与温度和压强无关,但气体摩尔体积与温度和压强有关,为易错点.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
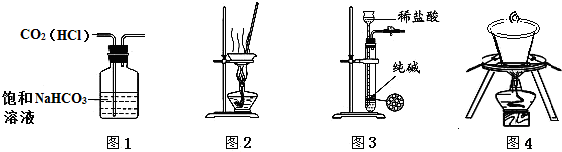
| A. | 用图1所示装置除去CO2中含有的少量HCl | |
| B. | 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| C. | 用图3所示装置制取少量纯净的CO2气体 | |
| D. | 用图4所示装置高温煅烧石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、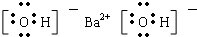 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
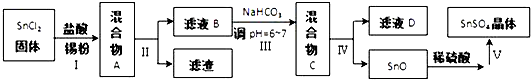

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漏斗 | B. | 玻璃棒 | C. | 烧杯 | D. | 容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com