
| A. | 钠与氧气反应时,产物只有一种 | |
| B. | 铝箔在空气中受热可以熔化且会发生剧烈燃烧 | |
| C. | 金属与非金属发生反应时,被氧化的一定是金属 | |
| D. | 铁丝不论在空气中还是纯氧中都不会燃烧 |
分析 A、钠和氧气反应产物不同时有反应条件决定;
B、铝在空气中不能燃烧;
C、金属原子结构可知金属单质一定失电子被氧化;
D、铁在纯氧气中燃烧生成四氧化三铁.
解答 解:A、钠和氧气反应产物不同时有反应条件决定,常温下钠和氧气反应生成氧化钠,钠点燃条件和氧气反应生成过氧化钠,故A错误;
B、铝箔在空气中受热可以熔化,但在空气中不能燃烧,故B错误;
C、金属原子结构可知金属单质一定失电子被氧化,金属与非金属发生反应时,被氧化的一定是金属,故C正确;
D、铁在纯氧气中燃烧生成四氧化三铁,空气中不能燃烧,故D错误;
故选C.
点评 本题考查了金属性质的分析,主要是反应条件、反应用量的分析判断,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
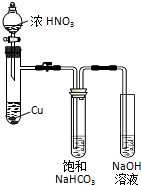 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常见单质的沸点:X<Y<W | B. | 简单氢化物的热稳定性:Y>Z | ||
| C. | 简单离子的半径:W>Y>Z | D. | 四种元素只能形成两种离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和氯水用棕色试剂瓶保存 | |
| B. | SO2和Na2SO3溶液都能使氯水褪色 | |
| C. | 常温下铁和铂都不溶于浓硝酸 | |
| D. | 硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 明矾净水的原理和“84”消毒液消毒的原理相同 | |
| C. | 为了防止中秋月饼等富脂食品氧化变质,延长保质期,可在包装袋中放入生石灰 | |
| D. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ AlO2- | B. | Na+ SO42- | C. | Cu2+ SO42- | D. | Na+ CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
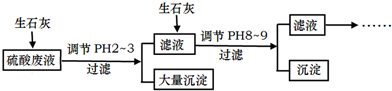
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 淀粉溶液中混有少量NaCl与蔗糖中混有少量NaCl | |
| B. | Fe(OH)3胶体中混有少量盐酸与淀粉溶液中混有少量KI溶液 | |
| C. | Na2CO3中混有少量NaHCO3与NaHCO3中混有少量Na2CO3 | |
| D. | CO2中混有少量SO2与CO2中混有少量HCl气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com