
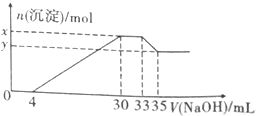
 在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | x-y=2×10-3mol | B. | 原溶液的pH=2 | ||
| C. | 原溶液中n(Cu2+)=0.025mol | D. | 原溶液中c(NH4+)=7.5×10-3mol•L-1 |
分析 在100mL含Cu2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入2.5mol•L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=$\frac{0.004L×2.5mol/L}{0.1}$=0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则c(NH4+)=$\frac{(0.033-0.03)L×2.5mol/L}{0.1L}$=0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Cu2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化铜需要NaOH体积=(30-4mL)-6mL=20mL,
则c(Cu2+)=$\frac{\frac{0.02L×2.5mol/L}{2}}{0.1L}$=0.25mol/L,c(Al3+)=$\frac{0.002L×2.5mol/L}{0.1L}$=0.05mol/L,
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Cu2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,据此分析解答
解答 解:在100mL含Cu2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入2.5mol•L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=$\frac{0.004L×2.5mol/L}{0.1}$=0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则c(NH4+)=$\frac{(0.033-0.03)L×2.5mol/L}{0.1L}$=0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Cu2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化铜需要NaOH体积=(30-4mL)-6mL=20mL,
则c(Cu2+)=$\frac{\frac{0.02L×2.5mol/L}{2}}{0.1L}$=0.25mol/L,c(Al3+)=$\frac{0.002L×2.5mol/L}{0.1L}$=0.05mol/L,
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Cu2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,
A.x为Al(OH)3、Cu(OH)2的物质的量,y为Cu(OH)2的物质的量,二者的差为Al(OH)3的物质的量=0.05mol/L×0.2L=0.01mol,故A错误;
B.通过分析知,c(H+)=$\frac{0.004L×2.5mol/L}{0.1}$=0.1mol/L,所以pH=1,故B错误;
C.原溶液中n(Cu2+)=0.25mol/L×0.1L=0.025mol,故C正确;
D.通过以上分析知,c(NH4+)=$\frac{(0.033-0.03)L×2.5mol/L}{0.1L}$=0.075mol/L,故D错误;
故选C.
点评 本题考查物质之间的反应,明确离子反应先后顺序是解本题关键,知道铝离子转化为氢氧化铝沉淀、偏铝酸钠时消耗NaOH的体积之比,结合电荷守恒解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O | |
| B. | 该反应中的氧化剂是H2O2,还原产物是O2 | |
| C. | 氧化性:H2CrO4>O2 | |
| D. | 如反应转移了0.3 rnol电子,则产生的气体在标准状况下体积为3.36 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1(NH4)2SO4溶液中:c(H+)>c(NH4+) | |
| C. | 0.1mol•L-1的HCl溶液与0.1mol•L-1的NaOH溶液等体积混合:c(H+)+c(Na+)═c(OH-)+c(Cl-) | |
| D. | 0.1mol•L-1 CH3COONa溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序为 W>Q>Z>X>Y | |
| B. | 元素 Y 与 W 对应氢化物的沸点 H2Y>H2W | |
| C. | 元素 X 与 Y 可以形成 5 种以上的化合物 | |
| D. | 元素 Q 的最高价氧化物对应的水化物酸性比 W 的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
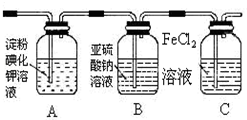
| 实验步骤 | 预期现象和结论 |
步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2mol/LHCl和1mol/LBaCl2溶液 振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42- |
步骤2:另取适量洗气瓶B中溶液于试管B中,滴加滴加入过量lmol/LBa(NO3)2溶液 振荡,静置. | 产生白色沉淀. |
步骤3:取步骤2后试管B中的上层清液于试管C中, 滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡.. | 若产生白色沉淀,则洗气瓶B溶液中存在氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH<7的溶液:Cu2+、Na+、Mg2+、NO3- | |
| B. | 滴加酚酞试液显红色的溶液:Fe3+、NH4+、Cl-、NO3- | |
| C. | 所含溶质为NaOH的溶液中:K+、SO42-、NO3-、H+ | |
| D. | 在碱性溶液:K+、HCO3-、Br-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的质量仍然相等 | B. | 溶质的质量仍然相等 | ||
| C. | 溶剂的质量仍然相等 | D. | 溶液的密度仍然相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com