
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与进步作出了巨大贡献。
(1)450℃时,在一个体积为2L的恒容密闭容器中充入0.4 mol N2和0.6 mol H2(10min时改变某一条件),测得反应过程中N2、H2和NH3的物质的量随时间变化如下表:
时间 物质的量 | 5 min | 10 min | 15 min | 20 min | 25 min |
n(N2)/mol | 0.36 | 0.35 | 0.275 | 0.25 | 0.25 |
n(H2)/mol | 0.48 | 0.45 | 0.225 | 0.15 | 0.15 |
n(NH3)/mol | 0.08 | 0.1 | 0.25 | 0.30 | 0.30 |
①5~10 min内,生成NH3的平均反应速率是_______ mol/(L·min)。
②下列能作为判断该反应达到化学平衡状态的依据是_______(填字母序号)。
A.v(N2)正=3v(H2)逆 B.容器内压强保持不变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子量不变
③第10 min时改变的条件是使用了高效催化剂,理由是_______。
(2)合成氨的反应原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH。
2NH3(g) ΔH。
相关化学键键能数据如下:
化学键 | H—H | N≡N | N—H |
E /(kJ/mol) | 436 | 946 | 391 |
由此计算ΔH=_______kJ/mol,低温下,合成氨反应_______(填“能”或“不能”)自发进行。已知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)![]() N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应Ⅰ:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H =﹣906kJ/mol
4NO(g)+6H2O(g) △H =﹣906kJ/mol
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H =﹣1267kJ/mol
2N2(g)+6H2O(g) △H =﹣1267kJ/mol
①该条件下,N2(g)+O2(g)![]() 2NO(g) △H = _______kJ/mol
2NO(g) △H = _______kJ/mol
②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应_______(填“反应Ⅰ”或“反应II”)。520℃时,反应Ⅰ的平衡常数K=_______(只列算式不计算)。
【答案】 0.002 BD 10~15min与5~10min相比较,三种气体物质的速率均增大,且增大相同倍数 -92 能 591 180.5 反应Ⅱ ![]()
【解析】本题主要考查影响化学平衡的外界条件、有关反应热的计算机平衡状态的判断、反应速率和平衡常数的计算等。
(1)①5~10 min内,生成NH3的平均反应速率是0.02/2/5 mol/(L·min)=0.002mol/(L·min)。
②A.v(N2)正=1/3v(H2)正=3v(H2)逆,故A 不能作为判断该反应达到化学平衡状态的依据;B.该反应气体物质的量减小,随着反应进行气体物质的量发生变化,使得压强发生变化,当容器内压强保持不变时,表明反应达到平衡状态,故B能作为判断该反应达到化学平衡状态的依据;C.气体质量不变,体积不变,容器内混合气体的密度一直保持不变 ,故C不能作为判断该反应达到化学平衡状态的依据;D.气体质量不变,随着反应进行,气体物质的量发生变化,使得混合气体的平均相对分子质量发生变化,当容器内混合气体的平均相对分子量不变时,表明反应达到平衡状态,故D能作为判断该反应达到化学平衡状态的依据。故选BD。
③第10 min时改变的条件是使用了高效催化剂,理由是10~15min与5~10min相比较,三种气体物质的速率均增大,且增大相同倍数。
(2)ΔH=反应物键能-生成物键能=(3×436+946-6×391)kJ/mol=-92kJ/mol,低温下,合成氨反应T△S绝对值较小,△H–T△S<0,该反应能自发进行。正逆反应活化能的差值等于反应热。已知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)![]() N2(g)+3H2(g)的活化能Ea2=(499+92)kJ/mol=591kJ/mol。
N2(g)+3H2(g)的活化能Ea2=(499+92)kJ/mol=591kJ/mol。
(3)①该条件下,(反应I-反应II)/2得N2(g)+O2(g)![]() 2NO(g) △H = 180.5kJ/mol
2NO(g) △H = 180.5kJ/mol
②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2,
该催化剂在较低温度时主要选择反应反应II。520℃时,各物质平衡浓度为c(NO)= c(N2)=0.2mol/L,c(NH3)=(1-0.2-0.4)mol/L=0.4mol/L,c(H2O)=1.5(0.2+0.4)mol/L=0.9mol/L,c(O2)=(2-0.1-0.45)mol/L=1.45mol/L,反应Ⅰ的平衡常数K=![]() =
=![]() 。
。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.无色溶液中:Na+、Cl、SO42﹣、Cu2+
B.使紫色石蕊溶液变红的溶液中:Na+、Ca2+、C032﹣、Cl﹣
C.含SO42﹣的溶液中:K+、Ba2+、CI﹣、Br﹣
D.酸性溶液中:Na+、S042﹣、Cl﹣、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率![]() x
x
A. ![]() (O2) = 0.01mol·(L·s) –1 B.
(O2) = 0.01mol·(L·s) –1 B. ![]() (NO) = 0.008mol·(L·s) –1
(NO) = 0.008mol·(L·s) –1
C. ![]() (H2O) = 0.006mol·(L·s) –1 D.
(H2O) = 0.006mol·(L·s) –1 D. ![]() (NH3) = 0.002mol·(L·s) –1
(NH3) = 0.002mol·(L·s) –1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液与Na2CO3溶液混合时产生蓝绿色沉淀,某实验小组进行实验,探究蓝绿色沉淀的组成。
【查阅资料】
i.氢氧化铜是一种蓝色絮状沉淀,难溶于水,溶于酸、氨水等,受热会分解。
ii.碳酸铜是蓝绿色粉末状固体,受热易分解,遇水转化为氢氧化铜和碱式碳酸铜的混合物。
iii.碱式碳酸铜呈孔雀绿颜色,又叫孔雀石,难溶于水,溶于酸、氨水等,在空气中加热会分解。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为CuCO3
假设3:沉淀为碱式碳酸铜[化学式可表示为xCuCO3yCu(OH)2]
(1)假设1中产生沉淀Cu(OH)2的离子方程式是_______。
(2)甲同学认为假设2不成立,理由是_______。
【定性实验】
(3)实验小组同学将沉淀从溶液中分离并净化,取少量净化后的固体于试管中,滴加稀硫酸,观察到_______,证明假设3成立。
【定量实验】
为了确定碱式碳酸铜化学式中x与y的关系,实验小组称取净化后的蓝绿色固体m1 g,使用下列装置(夹持仪器未画出)进行实验。
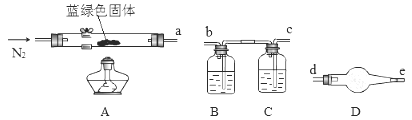
(4)B、C、D中的试剂依次为_______(填标号)。
a.澄清石灰水 b.碱石灰 c.氯化钙溶液 d.浓硫酸
(5)各装置接口的连接顺序:a→_______(填字母序号)。
(6)装置D的作用是_______。
(7)加热到固体完全分解,硬质玻璃管中得到黑色固体,其余产物被相应装置完全吸收。实验结束后,测得装置B的质量增加m2 g,则xCuCO3yCu(OH)2中![]() =_______(列式表示)。若无D装置,则
=_______(列式表示)。若无D装置,则![]() 的值_______(填“偏大”或“偏小”或“无影响”)。
的值_______(填“偏大”或“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用还原铁粉制备二茂铁开辟了金属有机化合物研究的新领域。二茂铁甲酰胺是其中一种重要的衍生物,结构如图所示。

(1)基态Fe原子价层电子排布式是_______。
(2)已知二茂铁甲酰胺熔点是176℃,沸点是249℃,难溶于水,易溶于氯仿、丙酮等有机溶剂。据此可推断二茂铁甲酰胺晶体为_______晶体。
(3)二茂铁甲酰胺中碳原子的杂化方式为_________,H、C、N、O四种元素的电负性由大到小的顺序是_________。
(4)碳、氮元素对应的最简单氢化物分别是CH4和NH3,相同条件下CH4的沸点比NH3的沸点_______(填“高”或“低”),主要原因是_______。
(5)氢、氮、氧三种元素按照4:2:3的原子个数比形成离子化合物。该离子化合物中,阳离子空间构型是_______,1 mol阴离子含有σ键的数目为_______。
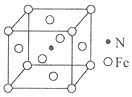
(6)氮和铁能形成一种磁性材料,其晶胞如图所示,该磁性材料的化学式为_______。已知晶胞参数为a nm,则该晶胞密度的计算式为ρ=_______g/cm3(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 反应MgO(s)+C(s)=Mg(s)+CO(g)在室温下不能自发进行,则该反应的△H>0
B. 原电池输出电能的能力取决于组成原电池的反应物的氧化还原能力
C. 0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A. 标准状况下,反应过程中得到6.72L的气体
B. 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C. 最终得到7.8g的沉淀
D. 最终得到的溶液中c(Na+)=1.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠与硫酸亚铁溶液反应,很难完整地观察到反应全过程的有关现象。有人用如右图装置进行实验改进:先在试管内新制备的硫酸亚铁溶液上面覆盖一薄层汽油,然后将试管放入烧杯中,待试管内汽油层消失后,往试管内投入一小粒钠并迅速塞上带导管的单孔塞。

(1)实验中汽油的作用是__________________________________________________。
(2)加入钠后观察到液面上有大量气泡逸出,溶液中有______色沉淀生成。
(3)如果往试管中加入汽油后即投入钠粒,可能发生爆炸,其原因是_____________。
(4)写出钠与FeSO4溶液反应的离子方程式:_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com