
|
有关NaHCO3和Na2CO3的性质,以下叙述错误的是 | |
A. |
等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积大 |
B. |
等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍 |
C. |
将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生白色沉淀 |
D. |
等物质的量浓度的两种溶液,Na2CO3溶液的pH大于NaHCO3溶液 |
|
解析:由于相对分子质量NaHCO3小于Na2CO3,所以等质量的NaHCO3、Na2CO3的物质的量n(NaHCO3)>n(Na2CO3),即在相同条件下产生CO2的体积NaHCO3的大,A项错;物质的量相等的NaHCO3、Na2CO3与HCl反应,消耗HCl的物质的量Na2CO3是NaHCO3的两倍,则消耗同浓度HCl的体积Na2CO3是NaHCO3的两倍,B项正确;NaHCO3溶液中 评注:正盐与酸反应时,先结合H+生成酸式酸根离子,再结合H+生成相应的酸(或酸酐和水). |


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:






| 一定条件 |
 +(n-1)H2O
+(n-1)H2O
| 一定条件 |
 +(n-1)H2O
+(n-1)H2O

 或
或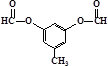
 或
或
 与G互为同分异构体
与G互为同分异构体查看答案和解析>>
科目:高中化学 来源: 题型:
(2011?福建模拟)已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
|
查看答案和解析>>
科目:高中化学 来源:2011届福建省四地六校高三毕业班考前模拟考试(理综)化学部分 题型:单选题
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省四地六校高三毕业班考前模拟考试(理综)化学部分 题型:选择题
已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com