
| A. | 高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g)═2Fe(OH)3+3H2 | |
| B. | 向新制的氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| D. | 向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ |
分析 A.不符合反应客观事实;
B.硝酸能够氧化二价铁离子;
C.氢氧化钠与二氧化硅反应生成硅酸钠和水;
D.不符合反应客观事实.
解答 解:A.高温下铁与水蒸气反应生成四氧化三铁和氢气,化学方程式:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故A错误;
B.向新制的氢氧化亚铁中加入足量的稀硝酸的离子反应为3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O,故B错误;
C.氢氧化钠与二氧化硅反应生成硅酸钠和水,离子方程式:SiO2+2OH-═SiO32-+H2O,故C正确;
D.向氯化铝溶液中加入过量的氢氧化钠溶液的离子方程式:Al3++4OH-═AlO2-+2H2O,故D错误;
故选:C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意离子方程式必须遵循客观事实,题目难度不大.


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,0.1NA个HCl分子的体积为22.4L | |
| B. | 标准状况下,22.4L氖气含有2NA个原子 | |
| C. | 1L 0.2mol/L硫酸铁溶液中含有的SO42-离子数目为0.6NA | |
| D. | 1mol氖气中含有的电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
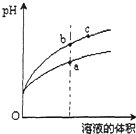 某温度下,相同pH的盐酸和醋酸分别加水稀释,pH随溶液体积变化的曲线如图所示,据图判断下列说法正确的是( )
某温度下,相同pH的盐酸和醋酸分别加水稀释,pH随溶液体积变化的曲线如图所示,据图判断下列说法正确的是( )| A. | b点酸的总浓度大于a点酸的总浓度 | |
| B. | c点溶液的导电性比b点强 | |
| C. | a点Kw的数值比c点溶液的Kw的数值大 | |
| D. | b点水电离产生的c(H+)比a点大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | 3.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 浓度商 |
| (1) | 0.0600 | 0.400 | 2.000 | 不填 |
| (2) | 0.0960 | 0.300 | 0.500 | 不填 |
| (3) | 0.0862 | 0.263 | 1.020 | 不填 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com