
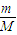 计算14.2g Na2SO4的物质的量,再根据c=
计算14.2g Na2SO4的物质的量,再根据c=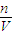 计算Na2SO4溶液的物质的量浓度,溶液中cn(Na+)=2c(Na2SO4),n(SO42-)=n(Na2SO4),再根据N=nNA计算SO42-的数目;
计算Na2SO4溶液的物质的量浓度,溶液中cn(Na+)=2c(Na2SO4),n(SO42-)=n(Na2SO4),再根据N=nNA计算SO42-的数目;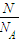 计算CO2的物质的量,CO2分子中n(O)=2n(CO2);根据V=nVm计算CO2的体积;含有O原子相等,则n(H2O)=2n(CO2),再根据m=nM计算水的质量.
计算CO2的物质的量,CO2分子中n(O)=2n(CO2);根据V=nVm计算CO2的体积;含有O原子相等,则n(H2O)=2n(CO2),再根据m=nM计算水的质量.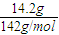 =0.1mol,故Na2SO4溶液的物质的量浓度为
=0.1mol,故Na2SO4溶液的物质的量浓度为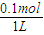 =0.1mol/L,溶液中cn(Na+)=2c(Na2SO4)=0.1mol/L×2=0.2mol/L;
=0.1mol/L,溶液中cn(Na+)=2c(Na2SO4)=0.1mol/L×2=0.2mol/L;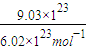 =1.5mol,CO2分子中n(O)=2n(CO2)=1.5mol×2=3mol;
=1.5mol,CO2分子中n(O)=2n(CO2)=1.5mol×2=3mol;

科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高一化学(上) 题型:013
在空气中放置一段时间的KOH固体,经分析知其中含水a%,K2CO3 b%.其余为KOH.取此样品m g溶于含H2SO4 9.8g的稀硫酸溶液中,所得溶液再加入n g KOH固体恰好中和,然后将溶液蒸干,可得固体物质的质量为
[ ]
查看答案和解析>>
科目:高中化学 来源:走向清华北大同步导读·高一化学 题型:013
在空气中放置一段时间的KOH固体,经分析知其中含水a%,含K2CO3b%,其余为KOH,取此样品mg溶于50g浓度为19.6%的稀硫酸中,所得溶液尚需加入ng KOH固体才能完全中和,然后将溶液蒸干可得固体物质的质量是
[ ]
A.3.1(m+n)g B.14.2g
C.17.4g D.不能确定
查看答案和解析>>
科目:高中化学 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:013
在一空气中暴露过久的KOH固体,经分析得知含水a%,含K2CO3 b%,其余为KOH取此样品m g溶于100 mL 1 mol/L的硫酸里,需加n g原样品才刚好中和完全,由此可知蒸干所得溶液可得无水固体的质量为
[ ]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com