
| A.HF、HCl、HBr、HI的热稳定性依次减弱 |
| B.熔点:Li> Na> K> Rb |
| C.NaF、NaCl、NaBr、NaI的熔点依次降低 |
| D.H2S的熔沸点小于H2O的熔沸点 |
科目:高中化学 来源:不详 题型:单选题
| A.在晶体中只要有阴离子就一定有阳离子 |
| B.1mol SiO2晶体中含2mol Si-O键 |
| C.干冰晶体中每个CO2分子周围紧邻12个CO2分子 |
| D.金刚石晶体中的最小环由6个碳原子构成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X是第ⅠA元素,Z是第ⅦA元素 |
| B.X、Y、Z三种元素的最高化合价依次升高 |
| C.Z的最高价氧化物对应的水化物是强酸 |
| D.如果Y的最高价氧化物的水化物难溶于水,则Y一定是Al |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
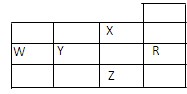
| A.W元素的第一电离能小于Y元素的第一电离能 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.最高价含氧酸的酸性,Y对应的酸性强于W |
| D.P能级未成对电子最多的是Z元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 族 周期 | IA | | 0 | |||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.x的原子半径大于y的原子半径 |
| B.x的第一电离能小于y 的第一电离能 |
| C.x的金属性大于y的金属性 |
| D.x的电负性大于y的电负性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com