
| 2g |
| 32g/mol |
| 1 |
| 16 |


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
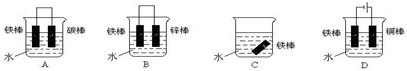
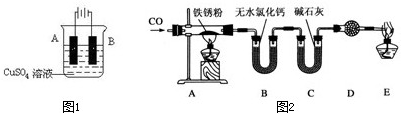
查看答案和解析>>
科目:高中化学 来源: 题型:
| 180℃ |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| x |
| 2 |
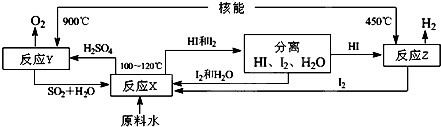
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
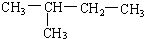 与
与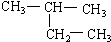
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称量前先调节托盘天平的零点 |
| B、称量时左盘放被称量物,右盘放砝码 |
| C、所有固体药品可直接放在天平托盘上称量 |
| D、用托盘天平可以准确称量至0.1g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com