
| A、pH=4的盐酸和pH=10的氨水 |
| B、pH=4的醋酸溶液和pH=10的氢氧化钠溶液 |
| C、0.1mol?L-1的盐酸和0.1mol?L-1的氢氧化钠溶液 |
| D、0.1mol?L-1的硫酸和0.1mol?L-1的氢氧化钡溶液 |


科目:高中化学 来源: 题型:
| A、原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32- |
| B、由实验①无法推断原混合溶液中是否含有SO42- |
| C、由实验①、②可判断原混合溶液中是否含有Fe3+ |
| D、由实验③可判断原混合溶液中存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
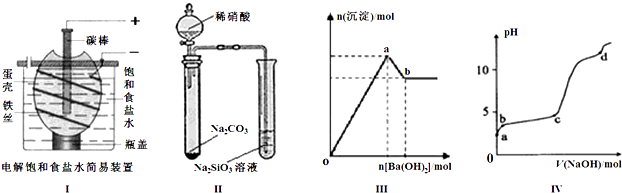
| A、按图Ⅰ装置电解一段时间后,往蛋壳外溶液中滴加几滴酚酞,溶液呈红色 |
| B、按图Ⅱ装置实验,可以证明酸性强弱关系为:硝酸>碳酸>硅酸 |
| C、图Ⅲ表示:向明矾溶液中逐滴加入Ba(OH)2溶液,生成沉淀的物质的量随Ba(OH)2加入量的变化曲线,则oa段发生的离子反应为: 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D、图Ⅳ表示:室温时,将1mol?L-1 NaOH溶液逐滴滴入0.2mol?L-1 Al2(SO4)3溶液中,实验测得溶液pH随NaOH溶液体积变化曲线,则d点时Al(OH)3沉淀开始溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
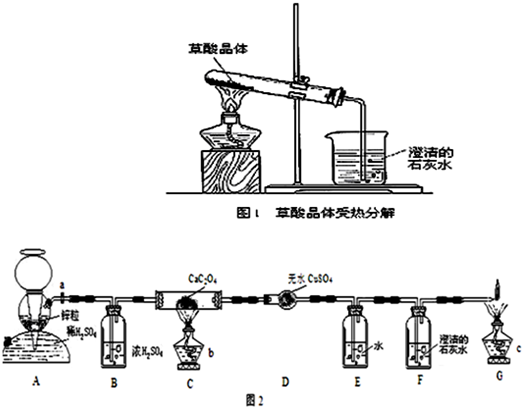
查看答案和解析>>
科目:高中化学 来源: 题型:
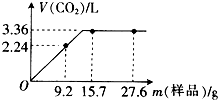 某同学用NaHCO3和KHCO3组成的混合物进行实验.现称取不同质量的该混合物溶于水后,分别滴入相同浓度的盐酸50mL,产生CO2气体的体积(标准状况下)与质量的关系曲线如图所示.
某同学用NaHCO3和KHCO3组成的混合物进行实验.现称取不同质量的该混合物溶于水后,分别滴入相同浓度的盐酸50mL,产生CO2气体的体积(标准状况下)与质量的关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入澄清石灰水除去NaHCO3溶液中混有的少量Na2CO3 |
| B、常温下,pH=1的水溶液中NO3-、I-、Na+,Fe3+可以大量共存 |
| C、硝酸铵溶液不能与镁反应生成氢气而氯化铵溶液能与镁反应生成氢气 |
| D、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.52 |
| B、11.70 |
| C、11.82 |
| D、12.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com