
���� ��1����n��Cu��=$\frac{32g}{64g/mol}$=0.5mol���������������ԭ��֮���ʧ������Ŀ��ȼ������NO�������
�����ɵĵ��������ֺ�������Ӧ�������ᣬ������Ӧ������Cuʧȥ���ӵ����ʵ������������õ����ӵ����ʵ������ݴ˼������������
��2��n��HNO3��=0.1L��0.8mol/L=0.08mol���ų���״���µ�����224mL��ΪNO����n��NO��=$\frac{0.224}{22.4}$=0.01��mol������Ӧ������Fe��NO3��2������NaOH����ҺΪNaNO3���Դ˼���NaOH�������
��3���������ᣬ����FeCl2��FeCl3���ɣ�2����֪n��Fe��NO3��2��=0.035mol����n��FeCl2��+n��FeCl3��=0.035mol������n��FeCl2����n��FeCl3��������������������NaCl���ɼ�������NaOH��Һ�������
��� �⣺��1����n��Cu��=$\frac{32g}{64g/mol}$=0.5mol����NO��NO2������ֱ�Ϊx L��yL����x+y=8.96L��
�ɵ��ӵ�ʧ�غ㣺$\frac{x}{22.4}$��3+$\frac{y}{22.4}$=0.5��2��
��ã�x=6.72��y=2.24��
�ʴ�Ϊ��6.72��
�����ɵĵ��������ֺ�������Ӧ�������ᣬ������Ӧ������Cuʧȥ���ӵ����ʵ������������õ����ӵ����ʵ��������������ΪVL��
����ת�Ƶ����غ��n��Cu����2=$\frac{V}{22.4}$��4=1��
V=5.6��
�ʴ�Ϊ��5.6��
��2��n��HNO3��=0.1L��0.8mol/L=0.08mol���ų���״���µ�����224mL��ΪNO����n��NO��=$\frac{0.224}{22.4}$=0.01��mol������Ӧ������Fe��NO3��2����n��NO3-��=��0.08mol-0.01mol��=0.07mol��
����NaOH����ҺΪNaNO3����n��NaOH��=n��NO3-��=0.07mol��
V��NaOH��=$\frac{0.07mol}{0.1mol/L}$=0.7L=700mL��
�ʴ�Ϊ��700��
��3���������ᣬ����FeCl2��FeCl3���ɣ�2����֪n��Fe��NO3��2��=0.035mol�������غ��֪n��FeCl2��+n��FeCl3��=0.035mol����3���루2����Ƚϣ��൱��FeCl3��NO�������ɣ��ɵ���ת����Ŀ���n��FeCl3��=$\frac{1}{3}$����5-2����0.01mol=0.01mol����n��FeCl2��=0.025mol����֪n��HCl��=n��NaOH��=2n��FeCl2��+3n��FeCl3���T0.08mol��
��V��NaOH��=$\frac{0.08mol}{0.1mol/L}$=0.8L=800mL��
�ʴ�Ϊ��800��
���� ���⿼��������ԭ��Ӧ���㣬Ϊ��Ƶ���㣬���ؿ���ѧ���������㼰֪ʶ��������ã���ȷ����������֮��Ĺ�ϵʽ�ǽⱾ��ؼ���ע��ת�Ƶ����غ����ȷ���ã���Ŀ�Ѷ��еȣ�


 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
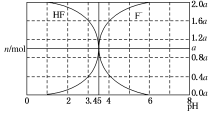 25��ʱ���� 2a mol•L-1 NaOH ��Һ�ζ� 1.0L 2a mol•L-1�������Һ���õ����Һ�� HF��F-�����ʵ�������Һ pH �ı仯��ͼ��ʾ������˵����ȷ���ǣ�������
25��ʱ���� 2a mol•L-1 NaOH ��Һ�ζ� 1.0L 2a mol•L-1�������Һ���õ����Һ�� HF��F-�����ʵ�������Һ pH �ı仯��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | pH=3 ʱ����Һ�У�c��Na+����c��F-�� | |
| B�� | c��F-����c��HF��ʱ����Һһ���ʼ��� | |
| C�� | pH=4 ʱ����Һ�У�c��HF��+c��Na+��+c��H+��-c��OH-����2a mol?L-1 | |
| D�� | pH=3.45 ʱ��NaOH ��Һǡ���� HF ��ȫ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ö��Ե缫��������Ȼ��ƣ�2Cl-+2H2O�TCl2��+H2��+2OH- | |
| B�� | ��ʳ�׳�ȥˮƿ�е�ˮ����CO32-+2CH3COOH�T2CH3COO-+CO2��+H2O | |
| C�� | ��ϡ����������Һ���ն���������2OH-+2NO2�TNO3-+NO��+H2O | |
| D�� | ������������Һ��ȥ�����������Ĥ��Al2O+2OH-�T2AlO2-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
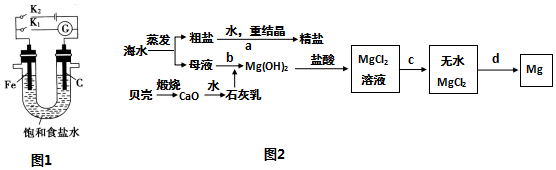
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
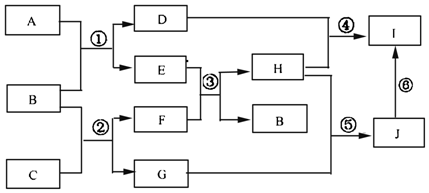
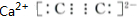 ��
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com