

分析 (1)温度越高,三氧化硫的逸出速率越大,升高温度,平衡向吸热反应方向移动;
(2)根据溶质在不同溶剂中的溶解度大小分析;
(3)当溶液变蓝色时,说明H2NSO3H恰好完全反应,根据H2NSO3H和NaNO2之间的关系式计算H2NSO3H的物质的量,再根据质量分数公式进行计算;
(4)用氢氧化钠测定氨基磺酸的纯度,测定结果通常比NaNO2法偏高,说明还有其它物质和氢氧化钠反应.
解答 解:(1)温度越高,三氧化硫气体逸出速率加快,且CO(NH2)2(s)+SO3(g)?H2NCONHSO3H(s)是放热反应,温度高,SO3气体逸出加快,反应①平衡向逆反应方向移动,使反应①转化率降低,
故答案为:温度高,SO3气体逸出加快,反应①平衡向逆反应方向移动,使反应①转化率降低;
(2)反应H2NCONHSO3H+H2SO4?2H2NSO3H+CO2↑是可逆反应,硫酸浓度增大,平衡向正反应方向移动,所以能抑制氨基磺酸的溶解,
故答案为:氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小;
(3)①氨基磺酸与NaNO2溶液反应的化学方程式:H2NSO3H+NaNO2=NaHSO4+N2↑+H2O,故答案为:H2NSO3H+NaNO2=NaHSO4+N2↑+H2O;
②当溶液变蓝色时,说明H2NSO3H恰好完全反应,氨基磺酸和亚硝酸钠的反应方程式为:H2NSO3H+NaNO2=NaHSO4+N2↑+H2O,
根据方程式知,n (H2NSO3H)=n(NaNO2)=25.00×l0-3×0.08000 mol•L-1=2.000×l0-3 mol,
ω(H2NSO3H)=$\frac{2.000×10{\;}^{-3}mol×97g/mol}{7.920g×\frac{25ml}{1000ml}}$×100%=98.0%,
故答案为:98.0%;
(4)用氢氧化钠测定氨基磺酸的纯度,测定结果通常比NaNO2法偏高,说明还有其它物质和氢氧化钠反应,能和氢氧化钠反应的物质是硫酸,故答案为:硫酸.
点评 本题考查测定物质的含量、化学平衡等知识点,会根据题给信息进行分析解答是解本题关键,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| B. | C6H6十Br2$\stackrel{Fe}{→}$C6H5Br+HBr | |
| C. | CH2═CH2+Br2CH2Br-CH2Br | |
| D. | CH3COOH+CH3CH2OH$→_{加热}^{浓硫酸}$CH3COOCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| D. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑦ | B. | ①④ | C. | ③④⑥ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
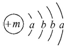 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | B. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 热稳定性:H2S>H2O>PH3>NH3 | D. | 原子半径:Na>S>O>F |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2CO3、NaHCO3两溶液中,离子种类不相同 | |
| B. | 在等体积、等物质的量浓度的Na2CO3、NaHCO3两溶液中,阳离子总数相等 | |
| C. | 在NaHCO3和Na2CO3混合溶液中一定有c(Na+)+c(H+)═c(HCO3-)+c(OH-)+2c(CO32-) | |
| D. | 在NaHCO3和Na2CO3混合溶液中一定有2c(Na+)=3[c(CO32-)+c(H2CO3)+c(HCO3-)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com