
【题目】现有一种制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
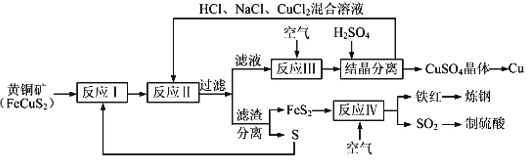
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣=2[CuCl2]﹣+S
请回答下列问题:
(1)传统工艺制铜是将铜矿砂与空气在高温下煅烧,使这种方法的缺点是要消耗大量的热能以及____________________________(完成合理的一种即可)。
(2)为使反应Ⅰ中充分进行,工业可采取的措施是_________(完成合理的一种即可),反应Ⅰ的产物为(填化学式) ___________________。
(3)反应Ⅲ的离子方程式为______________________________________,一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是____________________________。
(4)工业上炼钢时,为了降低含碳量,可将铁红投入熔融的生铁(含碳量大于2%的铁碳合金)中,该过程中主要反应的化学方程式是___________________________________。
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取560mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000molL﹣1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液50.00mL。
已知Cr2O72﹣+Fe2++H+→Cr3++Fe3++H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ____________________________ 。
②反应Ⅳ所得气体中SO2的体积分数为_________________ 。
【答案】SO2会导致大气污染 粉碎固体 FeS2、CuS 4CuCl2﹣+O2+4H+═4Cu2++8Cl﹣+2H2O 该温度下,硫酸铜的溶解度小于氯化铜 3C+Fe2O3![]() 2Fe+3CO↑ SO2 + 2Fe3++ 2H2O=SO42-+ 2Fe2++ 4H+ 12.00%
2Fe+3CO↑ SO2 + 2Fe3++ 2H2O=SO42-+ 2Fe2++ 4H+ 12.00%
【解析】
FeCuS2经反应Ⅰ转化为FeS2、CuS。反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣=2[CuCl2]﹣+S,FeS2、CuS经反应Ⅱ转化为FeS2、S、Na[CuCl2]、HCl。过滤分别得到滤液Na[CuCl2]、HCl,滤渣FeS2、S。Na[CuCl2] 经反应Ⅲ氧气氧化[CuCl2]﹣离子,转化成CuCl2。CuCl2溶液中加入稀硫酸,析出硫酸铜晶体。CuSO4溶液可置换或者电解得到单质铜。FeS2经反应Ⅳ氧气氧化得到Fe2O3和SO2。Fe2O3与过量碳反应生成铁和一氧化碳,制得钢。SO2可以氧化并与水反应生成硫酸。
(1)FeCuS2在高温下煅烧,会要消耗大量的热能,其次生成的SO2会导致大气污染;
(2)为使反应Ⅰ中充分进行,工业可采取的措施是粉碎固体。根据黄铜矿中元素的化合价、单质S的化学性质以及反应Ⅱ的离子方程式可知,反应Ⅰ的产物为FeS2、CuS;
(3)反应Ⅲ是氧气氧化[CuCl2]﹣离子,所以该反应的离子方程式为4CuCl2﹣+O2+4H+═4Cu2++8Cl﹣+2H2O。由于该温度下,硫酸铜的溶解度小于氯化铜,所以会析出硫酸铜晶体;
(4)工业上炼钢时,为了降低含碳量,可将铁红投入熔融的生铁中,因为碳过量,故生成一氧化碳,该过程中主要反应的化学方程式是:3C+Fe2O3![]() 2Fe+3CO↑;
2Fe+3CO↑;
(5)①硫酸铁能氧化SO2生成硫酸,则SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为SO2 + 2Fe3++ 2H2O=SO42-+ 2Fe2++ 4H+;
②560mL(标准状况)气体样品物质的量为![]() =0.025mol,消耗K2Cr2O7的物质的量是.02000molL﹣1×0.05L=0.001mol,则根据电子电子守恒可知,亚铁离子的物质的量是0.001mol×6=0.006mol,所以根据方程式可知,SO2的物质的量是0.006mol÷2=0.003mol,因此反应Ⅳ所得气体中SO2的体积分数为
=0.025mol,消耗K2Cr2O7的物质的量是.02000molL﹣1×0.05L=0.001mol,则根据电子电子守恒可知,亚铁离子的物质的量是0.001mol×6=0.006mol,所以根据方程式可知,SO2的物质的量是0.006mol÷2=0.003mol,因此反应Ⅳ所得气体中SO2的体积分数为![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一种Cu-Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON)隔开。下列说法正确的是
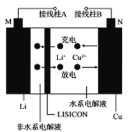
A. 陶瓷片允许水分子通过
B. 电池放电时,N极上发生氧化反应
C. 电池充电时,接线柱B应与外接直流电源的正极相连
D. 电池充电时,阳极反应为Li++e-=Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. NaHSO4在水溶液中的电离方程式:NaHSO4===Na++HSO4-
B. HF与NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ/mol
C. 1g H2燃烧生成液态水放出142.9 kJ的热量,其热化学方程式:2H2(g)+ O 2(g) = 2H2O (l) ΔH = —142.9 kJ·mol-1
D. CaCO3沉淀溶解平衡方程式:CaCO3(s) ![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某个体小煤矿曾发生瓦斯爆炸事故,造成人员伤亡。在煤矿矿井里,必须采取安全措施,如通风、严禁烟火等,而且要随时检查瓦斯的体积分数,如果空气中含甲烷的体积分数为5%~15.4%,遇到明火会发生爆炸。发生最强烈爆炸时空气中甲烷所占的体积分数约是
A. 5% B. 9.1% C. 10.5% D. 15%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
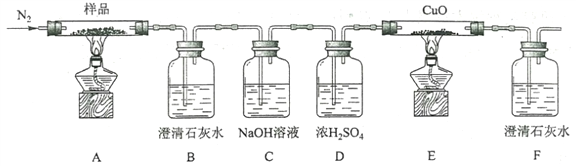
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是____(填元素名称),写出⑧的原子结构示意图______。
(2)最高价氧化物对应的水化物中,碱性最强的是___(用化学式回答,下同),酸性最强的是___。
(3)①与⑤形成的化合物中,化学键类型为_____。
(4)⑦与⑨形成的化合物的电子式为___,②与④形成的原子个数比为1:2的化合物的结构式为____。
(5)③、④、⑥的原子半径由大到小的顺序为_____(用元素符号回答)。
(6)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:

a.溶液B的作用是_______
b.若看到____现象,即可证明酸性_______(用化学式回答),则非金属性_______(用元素符号回答)。
c.上述实验中,能说明②和⑧非金属性强弱的化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
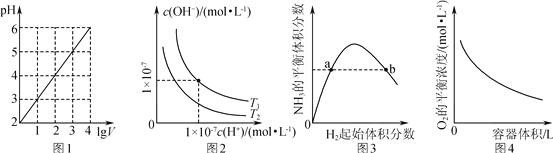
A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) ![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
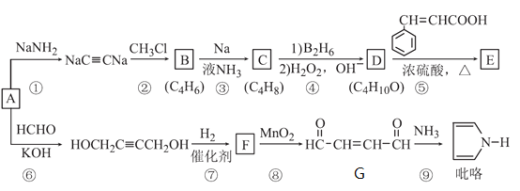
回答下列问题:
(1)A的官能团名称是_______________;C的名称是_______________;
(2)⑥的反应类型是_______________。⑧的反应类型是_______________。
(3)反应⑤的化学方程式为____________________________。
(4)满足下列条件的肉桂酸(![]() )的同分异构体共有_________种(不考虑立体异构):①含有苯环 ②能让溴的四氯化碳溶液褪色 ③能水解。与G互为同分异构体,且核磁共振氢谱只有一组峰的有机物的结构简式是________。(任写一种)
)的同分异构体共有_________种(不考虑立体异构):①含有苯环 ②能让溴的四氯化碳溶液褪色 ③能水解。与G互为同分异构体,且核磁共振氢谱只有一组峰的有机物的结构简式是________。(任写一种)
(6)参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯(![]() )的合成路线_________________________________。
)的合成路线_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬酸铅(PbCrO4)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
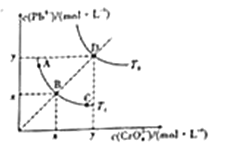
A. 图中x和y分别为T1,T2温度下PbCrO4在水中的溶解度
B. 图中各点对应的Ksp的关系为Ksp(A)=Ksp(C)<Ksp(B)<Ksp(D)
C. 向A点的溶液中加入少量Na2CrO4固体,溶液组成由A沿ABC线向B方向移动
D. 温度降低时,D点的饱和溶液的组成由D沿DB线向B方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com